
Zur mathematischen Herleitung des Bohrschen Atommodells
Spötter meinen: „Chemie ist nur die Physik der äußeren Elektronenhülle“. Deshalb müssen
alle Schüler mit einigermaßen geregeltem Chemieunterricht das Atommodell
von Niels Bohr (1885-1962) kennenlernen. Vielleicht wird auch in Leistungskursen
eingehender auf die Theorie, die dahinter steckt, eingegangen. Das gilt natürlich auch
für Studierende der Chemie oder Physik.
Manchmal wird einigen Schülern die Freude zuteil, den mathematischen Weg
nachvollziehen zu dürfen, der ausgehend von den zwei Postulaten zum Bohrschen
Atommodell führte. Da wird natürlich viel auswendig gelernt. Das muss aber nicht sein.

Linienspektrum des Wasserstoffs
Zur historischen Ausgangslage sei gesagt, dass man schon das Spektrum des Wasserstoffs kannte. Es besteht aus Linien, die hinsichtlich der Wellenlänge bzw. der Frequenz nicht linear, sondern anders angeordnet zu sein schienen. Der Mathematiker Balmer kam darauf, dass es sich hier um eine Potenz-Reihe handeln müsste. Er leitete durch Probieren am Schreibtisch folgende Beziehung ab:
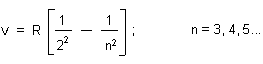
n ist die Frequenz, R eine Konstante (Rydberg-Konstante) und n eine Laufzahl.
Niels Bohr gelang es viele Jahre später, diese Beziehung auch physikalisch sinnvoll zu erklären.
Hier zunächst die zwei Bohrschen Postulate:
1 Für jedes Atom gibt es eine Anzahl von stationären
Zuständen, in denen das Atom nicht strahlt. Die Änderung seines Energieinhalts kann nur durch Übergang
von einem stationären Zustand in einen anderen erfolgen.
2 Die Frequenz der bei einem Übergang zwischen zwei stationären Zuständen ausgestrahlten oder adsorbierten Wellen genügt der Bedingung
(1)
(h ist das Plancksche Wirkungsquantum, n die Frequenz der Strahlung, E ist die Energie des jeweiligen Zustands.)
Besondere Verständnis-Schwierigkeiten bereitet Schülern folgender Text, der stets zu Beginn von Bohrs Rechnungen zitiert wird:
|
Die Annahme von Niels Bohr
|
Wie ist das zu verstehen, wie kam Niels Bohr darauf?
Was ein linearer Impuls ist, wissen die meisten:
(m ist die Masse des Körpers, v seine Geschwindigkeit.)
Ein Drehimpuls ist aber wie folgt definiert:
(2)
(m ist die Masse des umlaufenden Körpers, r sein Bahnradius, w seine Winkelgeschwindigkeit.)
Die Bohrsche Annahme für die n-te Bahn lautet in Formelsprache:
(3)
(n und p sind Konstanten.)
Daraus folgt die "Startgleichung" (4) für die mathematische Herleitung einer Beziehung, mit deren Hilfe man erstmals die Ursache für die mathematische Gesetzmäßigkeit der Linienstruktur des Wasserstoffspektrums verstand. (Diese Gesetzmäßigkeit war bislang von dem Mathematiklehrer Balmer nur empirisch gefunden worden.)
(4)
Wieso aber setzt Bohr den Drehimpuls pn des
kreisenden Elektrons gleich h / 2 p ?
Um das zu verstehen, führen wir je eine Dimensionsbetrachtung auf der rechten und
der linken Seite der Gleichung (4) durch.
Zur rechten Seite:
n und p sind dimensionslose Konstanten. Die
Konstante h ist das Plancksche Wirkungsquantum h = 6,625 ·
10-27 erg s. Seine Dimension ist also
(5)
Zur linken Seite:
Die Winkelgeschwindigkeit hat die Dimension [Zeit-1].
(6)
Die Größen Masse, Länge und Zeit spielen bekanntlich auch bei der Definition der Energie eine Rolle. Als Beispiel wählen wir die potentielle Energie:
(7)
(m ist Masse, g ist die Erdbeschleunigung (m/s2), s ist der Weg bzw. die Länge.)
Die Dimensionen sind
(8)
Stellen wir in Gl. (6) den Dimensions-Ausdruck etwas um und erweitern wir ihn formal mit der Zeit, so erhalten wir
(9)
Wir erkennen darin rot markiert die Dimensionen in (8) wieder und können festhalten: Der Ausdruck (6) m · r 2 · w hat folglich die Dimension
[Energie · Zeit] = [Wirkung]
Der Drehimpuls des Elektrons auf seiner Kreisbahn ist also eine Wirkung - wie das Plancksche Wirkungsquantum.
Das wusste Niels Bohr als gelernter Physiker natürlich! Deshalb war er in der Lage, die Gleichung (3) zu formulieren.
Was lernen wir daraus?
Man sollte in Physik und Chemie viel mehr Dimensionsbetrachtungen durchführen;
das ist nicht nur eine hervorragende Fehlerkontrolle beim Aufstellen von Gleichungen,
sondern meistens auch wichtig für das Verständnis.
Noch eine Anmerkung
Es wird immer wieder gefragt, wieso Bohr auf die Bezeichnungen K, L, M-Schale gekommen ist. Soviel sei
gesagt: Es war gar nicht der Bohr. Mehr dazu lesen Sie in der Abteilung Kurze Fragen /
Kurze Antworten Nr. 822.