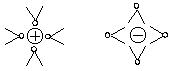
Das unterschiedliche Lösungsverhalten von Salzen und Gasen in
Wasser
Experimente:
Salze lösen sich in warmem Wasser schneller
Luft löst sich in Wasser
Aussalzen von Gas aus seiner wässrigen Lösung
Salze lösen sich besser, wenn man während des Lösungsvorgangs erwärmt.
Bei Gasen ist es genau umgekehrt.
Hier die Erklärung für Eilige
Grundsätzlich lagern sich Wassermoleküle mit den kleinsten Teilchen der zu
lösenden Stoffe zusammen.
Salze bilden mit Wasser relativ stabile Aggregate, die durch Erhitzen kaum zu
zerlegen sind. Erwärmen hat zudem die Verteilung dieser Aggregate in der Lösung
zur Folge. (Das gilt auch für Zucker.)
Dagegen bilden Gase wie Stickstoff, Sauerstoff oder Kohlenstoffdioxid mit den
Wassermolekülen lockerer gebaute Aggregate, die durch Wärmezufuhr leicht zerlegt
werden können. Außerdem werden die Gase durch Erwärmen aus der Flüssigkeit
ausgetrieben.
Jetzt etwas genauer
Beim Lösungsvorgang geht es um die physikalische Wechselwirkung zwischen den
zu lösenden Teilchen und den Teilchen des Lösemittels (beispielsweise Wasser).
Die Vorgänge laufen an den Phasengrenzen Kristall/Wasser bzw. Gasraum/Wasser
ab.
Egal ob es sich um die Lösung von Gasen oder Kristallen handelt: Grundsätzlich
werden Teilchen der zu lösenden Materie von Wassermolekülen umhüllt. Der
Vorgang ist die Hydratation (Solvatation). Anschließend werden diese Aggregate
durch Diffusion und (beim Erwärmen unterstützt durch Konvektionsströme)
wegtransportiert und gleichmäßig verteilt.
Wie sich Salzkristalle lösen
Beim Lösen eines Salzes bauen sich Ionen/Wasser-Aggregate auf. Um jedes
gelöste Teilchen sammeln sich in oftmals exakter geometrischer Anordnung
definierte Mengen von Wassermolekülen. Man spricht von Hydrathüllen.
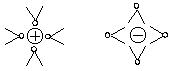
Anordnung von Wassermolekülen in Lösung um Salz-Ionen
Dabei sind die Wechselwirkungen zwischen den Teilchen erstaunlich stark. Bei
Ionenkristallen (wie im Kochsalz) sind das Ion/Dipol-Kräfte. (Bei Zuckerkristallen
bilden sich aufgrund von Dipol/Dipol-Wechselwirkungen nur
Wasserstoffbrückenbindungen aus.)
Bei fast allen Kristallen gilt:
Kristall + Wasser + Energie ———> Kristallbausteine (aq)
Ist die Energie der innerkristallinen Wechselwirkung (Gitterenergie) kleiner als die der Wechselwirkungen zwischen Kristallbausteinen und Lösemittelmolekülen, so löst sich der Kristall leicht auf. Im umgekehrten Fall löst sich der Kristall schlecht oder gar nicht. Dann bedarf es auch viel mehr Wassermoleküle, die Ionen zu isolieren, also auf Abstand zu halten, damit sie sich nicht wieder treffen und wiedervereinigen können. Hierbei hilft auch Erwärmen. Denn das steigert die Bewegung der Lösemittelmoleküle.
Insgesamt wird der Lösungsvorgang von Salzen oder Zucker durch Erwärmen
gefördert. Die Gründe sind: Die Wasserteilchen bewegen sich schneller, außerdem
schwingen die Teilchen des Kristallgitters heftiger. Dadurch kann die Gitterenergie,
also die Wechselwirkung zwischen den Kristallbauteilen, die den Kristall
zusammenhält, überwunden werden. Hinzu kommt: Durch das Erwärmen ist auch
die Lösungsumgebung des Kristalls turbulenter; die von den Lösemittelmolekülen
eingehüllten Kristallbausteine können leichter wegwandern und machen so die
Kristalloberfläche für weitere Angriffe der "freien" Wassermoleküle frei.
Das dauert so lange, bis der gesamte Kristall gelöst ist. Wenn allerdings nicht
genügend Wassermoleküle da sind oder wenn die Wechselwirkungsenergie zu klein
ist, bleibt ein ungelöster Bodensatz zurück. Wir sprechen dann von einer
gesättigten Lösung. In diesem Zustand gehen die von Wassermolekülen umhüllten
Ionen rasch wieder auf ihr Gitter zurück. Das ist auch der Grund für die geringe
Löslichkeit vieler bodenbildender Salze wie Kalk oder Silikate.
Wie sich Gase lösen
Auch um Gasmoleküle herum baut das Wasser eine Hydrathülle auf. Die sieht
anders aus als diejenige bei den Ionen oder bei den Zuckermolekülen. Die
Gashydrathülle muss man sich wie einen Käfig aus Wassermolekülen vorstellen.
Diese Käfige sind der Grund dafür, weshalb bei Gasen das Lösen durch Erwärmen
erschwert wird. Denn die Bindungen zwischen gelösten und den Lösemittelteilchen
sind gegenüber den oben erwähnten Ion/Dipol- oder Dipol/Dipol-Wechselwirkungen
wesentlich geringer. Deshalb reicht schon eine geringe Energiezufuhr zur Zerstörung
der Hydrathüllen aus.
Beim Erwärmen wird die große Hydrathülle um das Gasmolekül gestört. Denn wenn
das Wasser wärmer wird, bewegen sich Wassermoleküle und Gasmoleküle in der
Lösung schneller. Außerdem verlassen die Gasmoleküle beim Verdunsten des
Wassers zusammen mit den Wassermolekülen die Wasseroberfläche. Umgekehrt
gelangen weniger Gasmoleküle ins Wasser hinein, da die als Dampf ausströmenden
Wassermoleküle die Gasmoleküle quasi "wegkicken".
Zur Lösungsenergie von Gasen sei angemerkt: Anders als bei den Salzkristallen wird beim Lösen von Gasen Energie frei.
Gas (gasf.) + Wasser (flüssig) ———> Gas (aq) + Energie
Der Vorgang ist exotherm, weil die zuvor rasch bewegten Wasser- und Gasmoleküle verlangsamt werden, indem sie Ordnungszustände aufbauen. Das ist etwa so, als wenn man ein Auto abbremst: Dessen kinetische Energie wird in Wärme (erkenntlich am Aufheizen der Bremsscheiben) umgewandelt.
Die Käfigstruktur ist auch der Grund dafür, dass man Flüssigkeiten durch Schütteln entgasen kann. Denken Sie an die Sektflasche... Besonders effektiv ist das Entgasen mit Ultraschall. Dessen hochfrequente Schwingungen zerstören die Wasserkäfige, das Gas kann entweichen. Das macht man zum Beispiel mit Lösemitteln bei der HPLC.
Die Lösungsvorgänge sind Gleichgewichtsreaktionen
Deshalb müssen wir die Reaktionsgleichungen so formulieren:
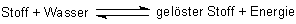
Das Vorliegen chemischer Gleichgewichte wird ganz besonders bei den Gasen deutlich. Das ist kein Wunder bei der Instabilität der Käfige und den kleinen Energiedifferenzen, die über deren Stabilität entscheidet.
Auch andere Stoffe lösen sich in Wasser
Die Diskussion betrifft nicht nur Gase, sondern auch weitere, als in Wasser
gewöhnlich als unlöslich geltende Stoffe wie Fette, Öle und
organischen Substanzen wie die Pestizide. Nur sind in
diesen Fällen die Wassermolekül-Käfige meist größer und viel komplizierter gebaut
und somit auch labiler, weshalb die Löslichkeit relativ gering ist.
Bei Seifen-Ionen kombinieren sich die Effekte: Es gibt Ion/Dipol-Wechselwirkungen
im geladenen hydrophilen Teil und die Bildung von Wassermolekül-Käfige um den
lipophilen Teil des Tensid-Moleküls.
Die Diskussion wird erheblich erschwert, wenn man die Lösung von Substanzen
betrachtet, die mit dem Lösemittel chemisch reagieren. Dann muss man in die
Überlegung die Reaktionsenergien und vor allem auch die Folgegleichgewichte
mit einbeziehen.
Was thermodynamisch dahintersteckt
Ein wichtiger Aspekt beim Lösen ist, wie sich der Ordnungszustand des Systems
verändert. Dazu muss man den Verlust an Ordnung des Kristalls vergleichen mit der
Zunahme der Ordnung der Wassermoleküle. Letztere konnten sich vorher mehr
oder weniger frei bewegen. Das ist ein Zustand hoher Unordnung. Beim Kristall ist
das umgekehrt: Beim Lösen wird die hohe Ordnung des Kristallgitters gestört.
Jedoch bilden sich ja bei der Bindung von Wassermolekülen an die Kristallbausteine
sich neue, wohldefinierte Molekül-Aggregate - es entsteht also wieder ein Zustand
höherer Ordnung.
Gase gehen dagegen vom Zustand großer Unordnung in den Zustand höherer
Ordnung über. Das betrifft vor allem auch das Wasser wegen der Bildung der
Wassermolekül-Käfige.
Kenner wissen: Hier greift das Stichwort Entropieänderung DS. Und ob sich ein Kristall (bzw. ein Gas) löst oder nicht, ist eine Frage der daraus resultierenden Gibbsschen Freien Energie DG. Damit sich etwas löst, muss die Änderung der Freien Energie immer negativ sein:
DG < 0
Man spricht statt von exothermen besser von exergonen Vorgängen.
Zusammengefasst
Die Bindungen zwischen den Salz-Ionen und den Wassermolekülen sind als
Ion/Dipol-Kräfte sehr fest, so dass Wärmezufuhr keine Zerlegung der Hydrathüllen
bewirkt, sondern nur die schnellere Diffusion der Teilchen/Wassermolekülaggregate
zur Folge hat. Das bedeutet schnelleres Lösen durch Wärmezufuhr.
Die Bindungen zwischen den meisten Gasen und den Wassermolekülen in den Wassermolekül-Käfigen sind dagegen sehr locker; es handelt sich um van der Waals-Bindungen. Bei Wärmezufuhr gibt es keine Verstärkung der Diffusion, sondern die Käfige brechen sofort auf, das Gasmolekül kann wieder austreten und wird aus der flüssigen Phase ausgetrieben.
Warum Kochsalz aus Mineralwasser das CO2 austreibt
Gibt man kristallines Kochsalz oder Saccharose (Haushaltszucker) in Mineralwasser oder Bier, so wird
um die Kristalle herum eine große Menge an CO2 freigesetzt. Das Wasser fängt an zu sprudeln
(-> Versuch). Dafür gibt es zwei Gründe:
| 1. | Das gelöste Gas befindet sich in einem metastabilen Zustand. Der Lösungsvorgang ist wie die umgekehrte Gasfreisetzung gehemmt und muss aktiviert werden. Als Aktivatoren wirken die Kristallkanten und bestimmte Bereiche der Kristallflächen. Man spricht gern von "aktiven Zentren" - wie bei den Enzymen. |
| 2. | Wenn das Salz mit dem Wasser Kontakt bekommt, löst es sich. Damit treten die Salz-Ionen mit den in Wassermolekül-Käfigen verpackten CO2-Molekülen in Konkurrenz um die Wassermoleküle. Diesen Wettbewerb verliert das CO2, da seine Bindungen zum Wasser schwächer sind. |
Der eingefleischte Thermodynamiker (der mir immer im Nacken sitzt und "wissenschaftlich exakte" Formulierungen anmahnt) hält von solchen modellhaften Erklärungen gar nichts. Er besteht auf folgender wissenschaftlich sauberen Erklärung: "Durch die Zugabe von einem Mol der löslichen Kristalle des Stoffs A zu einem Mol Lösemittel B erhöht sich das chemische Potential des Systems A/B." Ich habe manchmal den Eindruck, dass für ihn letztlich nur die Ergebnisse seiner Berechnungen dafür verantwortlich sind, dass es zur Gasfreisetzung kommt... (So sind sie, die Theoretiker!)
Weitere Texte zum Thema „Wasser“