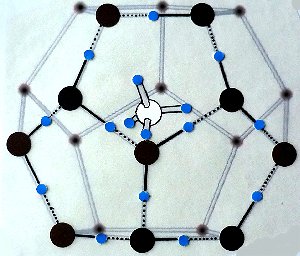
Die Struktur von Methan-Eis
In letzter Zeit hört man viel über Methan-Eis. Das ist bekannt als „brennendes Eis“. Es handelt sich um Einschlussverbindungen (Clathrate) von Methan in Wasser, die sich in großen Tiefen der Meeresschelfe bilden.
Dabei umhüllen 20 Wassermoleküle direkt ein Methanmolekül. 20 gleichmäßig verteilte Eckpunkte bilden bekanntlich ein Pentagondodekaeder. Die folgende Graphik zeigt diese Struktur. Zur Erklärung der Bindungsverhältnisse sind einige Wasserstoffbrückenbindungen eingezeichnet.

Struktur von Methan-Eis (verändert nach GFZ)
Die Sauerstoffatome sind schwarz, die Wasserstoffatome blau gezeichnet.
In der Mitte befindet sich das Methanmolekül
Wenn man sich in dieses Bild hineindenkt oder es selber konstruieren will, fallen einem rasch Ungereimtheiten auf:
1 Wasser bildet im festen Zustand doch eigentlich trigonale Strukturen - wie z. B. im Kristallgitter von Eis.
Offenbar ist es hier so, dass das kubische Tetraeder des Methanmoleküls den direkt angrenzenden Wassermolekülen eine ebenfalls kubische Nahordnungsstruktur aufzwingt. Das ist energetisch relativ einfach, weil der Bindungswinkel eines Wassermoleküls mit 104,5 ° dem Innenwinkel eines Pentagondodekaeders (108 °) ähnelt.
2 Ein Pentagondodekaeder verfügt über 20 Ecken, in denen die Sauerstoffatome der Wassermoleküle liegen. Die 20 Sauerstoffatome sind über 30 Kanten verbunden, auf denen die H-Atome liegen. 20 Wassermoleküle enthalten jedoch 40 Wasseratome. Hinzu kommt ja noch die gleiche Anzahl an Wasserstoffbrücken.
Man kann also zusammenfassend sagen, dass das Methanmolekül von 20 Bindungstetraedern des Wassers umgeben ist.
Einige Wassermoleküle richten ihre kovalenten Bindungen bzw. Wasserstoffbrücken aus dem Pentagondodekaeder hinaus und bilden auf diese Weise um den kubischen Körper eine große Raumstruktur, die ins umgebende Wasser hineinragt.
Weitere Texte zum Thema „Wasser“
Weitere Texte zum Thema „Kohlenwasserstoffe“