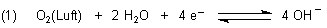
Zur Oxidationswirkung von Sauerstoff in alkalischen Lösungen
In einem Tipp des Monats beschreiben wir, wie man Kohlsuppen geruchsfrei machen kann. Dazu soll man Kaisernatron® hinzufügen. Dabei werden vor allem die mehr oder weniger stinkenden Schwefelverbindungen durch Luftsauerstoff oxidiert. Wir erklären das damit, dass durch den Zusatz von Kaisernatron, also Natriumhydrogencarbonat, der pH-Wert der Lösung zunimmt und damit die Oxidation erleichtert wird.
Andererseits wissen wir, dass die Oxidationskraft des Sauerstoffs sinkt, wenn die Lösungen alkalischer werden. Wie kann dann die Wirkung von Natriumhydrogencarbonat bzw. von alkalischen Zusätzen wie Soda positiv beeinflusst werden?
Das Redox-Gleichgewicht des Sauerstoffs lautet:
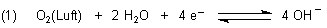
Je mehr Hydroxid-Ionen vorhanden sind, desto mehr verschiebt sich das Gleichgewicht auf die linke, nicht reagierende Seite.
Nun muss man aber auch das zu oxidierende System mit einbeziehen. Aus müffelnden Schwefelverbindungen sollen geruchlose Schwefelsauerstoff-Verbindungen werden. Bemerkenswert ist, dass der Schwefel primär gar nicht mit dem Sauerstoff der Luft reagiert, sondern mit Wassermolekülen. Diese sind Dipole und docken in Lösungen sowieso immer an den Schwefel an.
Hier ist die Gleichung für das Redox-Gleichgewicht einer beliebigen, stinkigen Schwefelsubstanz:

Will man dieses Gleichgewicht im Sinne einer Oxidation des Schwefels nach rechts verschieben, muss man die entstehenden Protonen entfernen. Das geschieht durch Zusatz von Hydroxid-Ionen, die mit den Protonen zu Wasser reagieren. Je alkalischer die Lösung ist, desto mehr wird das Gleichgewicht auf die rechte Seite verschoben, desto leichter wird der Schwefel oxidiert.
Die beiden Gleichgewichte (1) und (2) laufen in Lösung zusammen ab. Daraus resultiert eine Gesamt-Reaktionsgleichung für den Redox-Prozess, die man formal durch Addition erhält. Da dabei die Zahl der Elektronen eliminiert werden muss, sind die Gleichungen entsprechend zu gewichten. (Wie man Redox-Gleichungen herleitet, erklären wir auf einer besonderen Webseite.)
Zu den folgenden Gleichungen (3a) und (3b) muss noch angemerkt werden, dass diese keine Gleichgewichte mehr beschreiben, da durch das Nebeneinander beider Reaktionssysteme Reaktionen nur noch in den angegebenen Richtungen ablaufen. Nur die resultierende Gesamt-Redox-Gleichung (3c) beschreibt wieder ein Gleichgewicht, nämlich das, welches sich nach Ende der Reaktion einstellt.
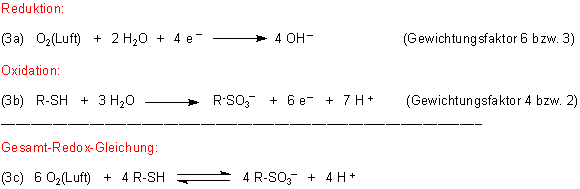
Jetzt stören genau genommen auf der rechten Seite des Gleichgewichts immer noch einige Protonen. Um auch dieses Gesamtgleichgewicht nach rechts auf die Seite der nahezu vollständigen Vernichtung von muffelnden Schwefelverbindungen zu verschieben, sollten wir noch mehr Hydroxid-Ionen - letztlich also noch mehr Kaisernatron oder Soda - zugeben.
Das hier Gesagt gilt übrigens für alle durch Sauerstoff oxidierbare Substanzen.
Weitere Texte zum Thema „Wasser“