
Warum der Salzgehalt in den Meeren konstant bleibt

Bild 1 (Foto: Blume)
Der Salzgehalt des offenen Meeres beträgt durchschnittlich 3,5 Masse%. Das ist erstaunlich gering!
Denn Flüsse transportieren ständig Salze ins Meer. Das geht schon seit Jahrmillionen und Jahrmilliarden so.
Warum wird das Salz nicht immer mehr?
Wir dürfen beim Begriff „Salz“ nicht nur an das leicht lösliche Natriumchlorid denken, auch wenn Natriumchlorid drei Viertel des gesamten Meersalzes stellt. Wir müssen in unsere Überlegungen auch die Kationen von Erdalkali- und Schwermetallen sowie die Anionen der Silicate (Tonmineralien), Carbonate, Hydrogencarbonate, Sulfate, Phosphate und vieles andere mehr einbeziehen. Grundsätzlich muss man sich daran erinnern, dass sich im Meerwasser (abgesehen vielleicht von den Edelgasen) mehr oder weniger das gesamte Periodensystem wiederfinden lässt… Daraus kann sich bei richtiger Kombination der entsprechenden Ionen ohne weiteres schwerlösliches Material bilden, das dann sedimentieren kann.
So ist dann auch der Grund für die erstaunliche Konstanz dieses Werts, dass sich ständig ein Teil des eingetragenen Salzes in den Sedimenten am Meeresboden ablagert, so dass sich ein Gleichgewicht eingestellt hat. Besonders rasch geht die Sedimentierung mit den Carbonaten von Calcium und Magnesium z. B. durch Bildung von Molluskenschalen, Korallen sowie durch Mikroorganismen wie Foraminiferen spielt eine Rolle. Auch Kalkalgen sind umfassend beteiligt, denn ihr Kalkmantel entsteht quasi als Nebenprodukt bei der Photosynthese. So beobachten wir ein ständiges Abrieseln von Kalksedimenten auf den Meeresboden. Man spricht von einem „Planktonregen“.
Die biologische Kalkbildung hat Bicarbonat-Anionen als eigentliches Substrat zur Voraussetzung. Das gilt auch für die Photosynthese der Algen.
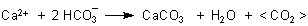
Das Symbol < CO2 > bedeutet irgendwie gebundenes CO2 – bei Algen z. B. in der Glucose. Tiere geben bei der Kalkbildung dieses CO2 als Gas ab oder reichen es (wie im Fall der Korallen) an die Algen weiter, die mit ihnen in Symbiose leben.
Zwar ist die Rückreaktion der Kalkbildung denkbar, wenn der CO2-Gehalt in der Lösung ansteigt. Damit sollte das Meerwasser, welches normalerweise einen pH-Wert von 8,1 hat, saurer werden. Das beobachtet man tatsächlich. Denn das zunehmend aus der Atmosphäre stammende, in Meerwasser gelöste CO2 zersetzt in der Form von Kohlensäure bzw. Hydrogencarbonat deutlich erkennbar die Mollusken- und Korallenschalen.
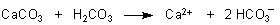
Die Ionen von Phosphat oder Silicat können ebenfalls mit Ionen der Erdalkalimetalle oder anderer Massenmetalle wie Eisen oder Aluminium reagieren. Hier folgen einige formale Reaktionsgleichungen.
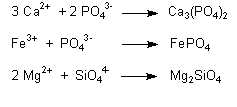
Schwermetalle lassen sich auch als Sulfide fällen. Das ist besonders bei Eisen der Fall.
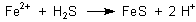
Der Schwefelwasserstoff entsteht durch anaerobe Bakterien in Faulschlämmen. Aus dem Eisensulfid kann sich Pyrit bilden.
Obwohl die Reaktion zwischen Sulfat und Calcium wegen möglicher Gipsbildung denkbar sein sollte, spielt sie doch nur eine Rolle beim Eindampfen von isolierten Meeresarmen und somit bei der Bildung von Salzseen und Salzlagerstätten.
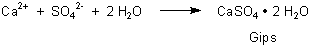
Wie steht es aber mit den sehr gut löslichen Chloriden der Alkali- und Erdalkalimetalle? Diese lassen sich ohne
starke Eindunstung des Meeres nicht direkt ausfällen. Sie werden jedoch z. B. durch schwerlösliche Tonmineralien,
die wie Ionenaustauscher wirken, eingeschlossen und mit diesen
sedimentiert.

Bild 2: Erdboden, der ins Meer geschwemmt wird (Foto: Blume)
Weitere Texte zum Thema „Wasser“