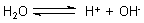
Wasser diktiert die pH-Skala
Mancher hat sich schon gewundert, warum die Reihe der pH-Werte ausgerechnet von
0 bis 14 reicht. Wir sind an das Dezimalsystem gewöhnt. Was soll dann dieser
Zahlenbereich?
Die Skala beginnt mit dem für stark saure Lösungen charakteristischen Wert 0 und
endet mit dem Wert 14 für stark alkalische Lösungen. Die Mittelzahl 7 beschreibt auch
die chemische Mitte, den Neutralbereich. Das wissen wir: Wenn gleichkonzentrierte
starke Säuren und Laugen miteinander reagieren, neutralisieren sie sich:
HCl + NaOH ———> NaCl + H2O
Saure Lösungen mit dem pH-Wert 0 sind einmolar, das heißt, sie enthalten in einem Liter
Lösung 6 · 1023 freie Protonen (bzw. Hydronium-Ionen
H3O+). Deren Konzentration beträgt als Zehnerpotenz geschrieben
100 mol/l. Eine saure Lösung mit pH 1 enthält nur ein Zehntel davon, also 0,1 mol/l
oder 6 · 1022 Protonen. Bei pH 2 sind es nur noch 0,01 mol /l oder
6 · 1021 Protonen. Es ist offensichtlich: Der pH-Wert hängt mit
der Protonenkonzentration zusammen.
Wir müssen uns daran erinnern, dass eine Zahlenreihe wie 0 und 0,1 und 0,001... als
Zehnerpotenzreihe dargestellt werden kann. Also: 1 = 100 und 0,1 = 10-1 und 0,01 =
10-2 und so weiter. Nimmt man die Hochzahlen absolut, also ohne das Minuszeichen,
so hat man den pH-Wert!
Was ist beim Neutralpunkt pH 7 los?
Hier ist die Konzentration der Protonen 10-7 mol/l. Darf es da überhaupt noch Protonen
geben? Dann müsste die Lösung ja sauer sein. Ein pH-Wert 7 steht aber für neutrales
Milieu. Wasser ist jedoch nicht stabil; es gibt wie eine Säure begrenzt Protonen ab.
Dabei bilden sich OH--Ionen.
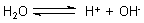
Es liegen somit genau so viel Protonen wie OH--Ionen vor. Die halten sich im Schach.
Und wie ist es bei pH 8? Das ist bereits alkalisches Milieu. Da ist die Konzentration der
Protonen 10-8. Die Konzentration der OH-Ionen muss dann also 10mal höher als bei pH
7, also 10-6 sein. Die absoluten Zehnerpotenzen der Konzentrationen von H+ und
OH- sind gegenläufig.
Nun ist es an der Zeit, auch einen pOH-Wert zu definieren.
Bei pH 14 ist die Lauge einmolar, das heißt, sie enthält in einem Liter Lösung 6 ·
1023 Hydroxid-Ionen. Deren Konzentration beträgt als Zehnerpotenz geschrieben 100 mol/l.
Der pOH-Wert ist 0. Bei pH 13 ist sie verdünnter, ihre Konzentration ist 10-1 mol/l,
der pOH-Wert ist 1. Bei pH 12 ist die Konzentration der Lauge 10-2
mol/l, der pOH-Wert 2... Und so weiter!
Wir sehen, dass die Summe der absoluten Zehnerpotenzzahlen immer 14 ist.
Es gilt also für jede Lösung:
pH + pOH = 14
Das bedeutet aber auch, dass die Summe der Zehnerpotenzen der Konzentrationen immer 14 ist. Folglich muss das Produkt der Konzentrationen von H+ und OH- immer 10-14 sein!
K = [H+] · [OH-] = 10-7 · 10-7 = 10-14
Das ist das berühmte Ionenprodukt des Wassers. Es ist eine Gleichgewichtskonstante.
Das Vertrackte bei der pH-Skala ist, dass wir Menschen bei einer solchen Zahlenreihe an lineare Zunahme denken. In Wirklichkeit beträgt die Konzentrationsänderung von einem pH-Wert zum nächsten nicht eins, sondern den Faktor 10. Und es ist noch komplizierter: Die Änderung von pH 2 auf 1 bedeutet wesentlich stärkere Versauerung als von pH 5 nach 4.
Klicke an: Anmerkungen zum pH-Wert für Spezialisten
Weitere Texte zum Thema „Wasser“