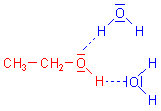
Die Molekülstruktur des Wassers beeinflusst dessen stoffliche
Eigenschaften
Experimente:
Versuch: Umwandlungstemperaturen von Wasser
Versuch: Wasser als Lösemittel für Lebensmittel und anderes
Versuch: Spülmittel beeinflussen die Oberflächenspannung von Wasser
Versuch: Wasser benetzt Oberflächen
Versuch: Luft löst sich in Wasser
Versuch: Öl verschmutzt Wasser
Versuch: Volumenzunahme beim Gefrieren von Wasser
Versuch: Flüssigkeiten benötigen beim Verdampfen Wärme
Ein alter Lehrerschnack besagt: "Wasser ist nass und gewinkelt". Dahinter steckt
Wahres.
Auf all den Eigenschaften der Wassermoleküle und des Wassers als chemischen Stoff beruhen viele für das Leben oftmals segensreiche Effekte, die die Anwesenheit von Wasser zur Voraussetzung haben.
A Energetische Auswirkungen der Wasserstoffbrücken-Bindungen
Wasserstoffbrückenbindungen haben eine Bindungsenergie von 15-40 kJ/mol. Das sind etwa
3 bis 5 % der Energie der kovalenten Bindung zwischen H und O (463 kJ/mol). Wasser hat deshalb
für eine Substanz, die aus sehr kleinen Molekülen aufgebaut ist, verglichen mit anderen
ähnlich aufgebauten Verbindungen wie Schwefelswasserstoff H2S, Ammoniak NH3
oder Methan CH4 extrem hohe Schmelz- und Siedetemperaturen und einen weiten Flüssigbereich
(-> Versuch und die Webseite "Ein
Blick ins PSE: Wenn Wasser wirklich nur H2O wäre"). Die damit verbundenen großen Umwandlungswärmen
werden beim Wechsel der Aggregatzustände im Wasser gespeichert oder bei der Umwandlung freigesetzt.
| Umwandlungsenthalpien und Wärmekapazitäten | ||||
| Wasser | Schwefelwasserstoff | Ammoniak | Methan | |
| Schmelzwärme kJ/mol | 6,00 | 2,38 | 5,65 | 0,94 |
| Verdampfungswärme kJ/mol | 40,75 | 18,67 | 23,35 | 8,26 |
| Spezifische Wärme J/K · mol | 75,15 | - | 35,52 | - |
Wegen des Aufbaus aus dreiatomigen gut schwingungsfähigen Dipol-Molekülen weist Wasser in allen drei
Aggregatzuständen eine sehr große Wärmekapazität auf.
Aus diesen beiden Gründen ist Wasser ein sehr guter Energieabsorber und
ein sehr gutes Energietransportmedium, also auch ein Temperaturpuffer.
B Grenzflächen und Fließverhalten
Wasser benetzt polare Oberflächen. An der Grenze zu nicht benetzbaren Oberflächen
wie Metall oder der Luft besitzt Wasser eine große Oberflächen- oder Grenzflächenspannung
(-> Versuch). Das rührt daher, weil die Moleküle des Wassers
durch Wasserstoffbrücken vor allem an der Grenzschicht stark gebunden zusammenhängen.
Weil die Wassermoleküle untereinander so stark gebunden sind, hat Wasser
verglichen mit anderen Flüssigkeiten eine hohe Viskosität.
C Wasser als Lösemittel
Wasserstoffbrücken-Bindungen werden auch zu anderen polaren Stoffen wie
Alkoholen oder Kohlenhydraten aufgebaut.

Zwischen Ionen und Wassermolekülen gibt es starke elektrostatische Wechselwirkungen.
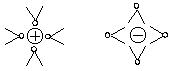
Wasserdipole umgeben in oktaedrischer Symmetrie die Ionen von NaCl.
(Die zwei außerhalb der Zeichenebene angeordneten Wasserdipole muss man sich dazu denken.)
Wasser ist deshalb ein hervorragendes Lösemittel gerade für polare Stoffe wie Salze
und die meisten Lebensmittel (-> Versuch).
Darauf beruht auch die Benetzung von polaren Oberflächen und das nasse Gefühl gegenüber
Wasser (-> Versuch).
Makromolekulare Lebensmittel wie Stärke oder Proteine quellen manchmal nur,
werden damit aber dem Angriff durch Verdauungsenzyme zugänglich gemacht.
Aber auch weniger polare Gase lösen sich hervorragend in Wasser
(-> Versuch). Die Luft enthält Sauerstoff und Stickstoff
im Verhältnis 1:4, Wasser dagegen 1:1,8. Deshalb können Fische und andere Kiementiere
im Wasser atmen. Andere Gase reagieren mit Wasser weiter zu Säuren. Darauf beruht der
saure Regen, aber auch die Ausgewogenheit der CO2-Bilanz der Atmosphäre
durch die Adsorptionskraft der Weltmeere.
Leider lösen sich aber auch völlig unpolare Stoffe wie Lösemittel (CKW), Dieselöl oder Pestizide im Wasser,
wenn auch nur in Spuren (-> Versuch). Dabei werden die unpolaren Moleküle
mit Netzstrukturen aus Wassermolekülen umhüllt. Hier berichten wir darüber,
weshalb zum Beispiel Dieselkraftstoff wassergefährdend ist, obwohl er sich nach Meinung vieler Leute und Nachschlagewerke
gar nicht mit Wasser vermischt.
Flüssiges Wasser bildet auf diese Weise unter Druck eisartige Einschlussverbindungen mit Gasen, die so genannten Clathrate. Der Einschluss von Methan ist für uns besonders wichtig, denn er kann sich als die bedeutendste Quelle für Erdgas herausstellen und so vielleicht zu unserer Energieversorgung beitragen.
Obwohl flüssiges Wasser ein so gutes Lösemittel ist, bildet Eis normalerweise keine Mischkristalle. Auch aus Salzlösungen wie dem Meerwasser kristallisiert deshalb immer reines Wassereis aus. Es kann in seinen Gitterzwischenräumen höchstens Gase einlagern.
D Die Struktur von Wassereis
Beim Gefrieren von Wasser bildet sich Eis, dessen Volumen um 1/11 oder 9 % größer
ist als das von flüssigem Wasser (-> Versuch).
Dabei gruppieren sich die Wassermoleküle so, dass sie sehr viel Raum einnehmen. Eis bildet in seinen
Kristallen Sechsringe.
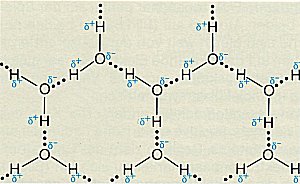
Zweidimensionale Struktur von Eis bei Normaldruck (Quelle: Cornelsen)
Die Ausbildung von Wasserstoffbrücken in Wassereis.
Die vierte Bindung, die jeweils von den Sauerstoffatomen ausgeht, ist nicht gezeichnet.
Das Bild zeigt, dass die Elementarzelle eine sperrige hexagonale Struktur aufweist. (Damit erinnert
das Eisgitter an die Gitterstruktur des Quarzes.) Diese Struktur
spiegelt sich in den sechseckigen Schneesternen wieder. Dies ist ein schönes Beispiel
dafür, wie die Struktur im Bereich der kleinsten Teilchen die des Stoffes bestimmt.
Eine dreidimensionale Darstellung des Wassereis-Gitters sowie Bilder von Schneekristallen zeigen wir auf der Webseite zum Wassereis.
E Volumenveränderungen beim Abkühlen und Erwärmen von Wasser
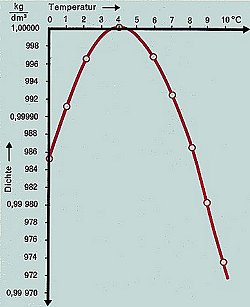
(Quelle: Cornelsen)
Beim Abkühlen verhält sich Wasser anomal. Normalerweise nimmt beim Abkühlen bei
allen bekannten Flüssigkeiten deren Volumen ab. Das beobachten wir zunächst auch
beim flüssigen Wasser, um bei 4 °C eine Überraschung zu erleben: Bei weiterem
Abkühlen nimmt das Volumen wieder zu, die Dichte also ab. Denn das Volumen von
flüssigem Wasser hat also bei 4 °C ein Minimum und nimmt danach wieder zu. Man
spricht von der Dichte-Anomalie des Wassers. Der Grund ist, dass sich bei dieser
Temperatur die Wassermoleküle zu sperrigen Strukturen zu ordnen beginnen, die in
die voluminösere Struktur von Eis münden.
Die Temperatur von Wasser bestimmt also dessen Dichte. Das gilt aber auch
umgekehrt: Unter hohem Druck (ab etwa 1,2 m Wassertiefe) bleibt die Temperatur des
Wassers bei 4 °C stehen. Sie kann nicht steigen oder niedriger werden, denn das
würde immer eine Volumenzunahme zur Folge haben müssen.
Beim Erwärmen nimmt im normalen Bereich der Volumen-Temperaturkurve des Wassers das Volumen zu. Das hat erhebliche Konsequenzen für die Auswirkungen des Treibhauseffekts. Denn bei Erwärmung um 1 °C steigt die Wasserhöhe der Meere weltweit um ca. 30 cm. Das scheint bei einer durchschnittlichen Wassertiefe von 1500 m nicht viel zu sein, hat aber Konsequenzen für viele Staaten. Das beschreiben wir in einer besonderen Webseite.
F Chemische Eigenschaften von Wasser
Wasser ist als Endprodukt einer stark exothermen Redoxreaktion ("Knallgasreaktion")
erstaunlich inert und reagiert in biologischem Milieu kaum mit anderen Substanzen, es
sei denn unter Mitwirkung von Katalysatoren (Enzymen).
Aufgrund seines polaren Molekülbaus sind im Wassermolekül die Bindungen zwischen
O und H gelockert. Deshalb bildet Wasser in gewissem Umfang Protonen, ist also eine
schwache Säure. Es kann aber auch Protonen aufnehmen, also als schwache Base wirken.
Wasser ist somit zugleich Säure und Base. Es ist also
amphoter. Damit kann es andere Säuren und Basen abpuffern.
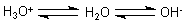
G Die Farbe von Wasser
Da Wasser kaum Licht absorbiert, erscheint es farblos, also sprichwörtlich "wasserklar".
Allerdings gibt es eine kleine Einschränkung, die zur blaugrünen Farbe
dichter Wasserschichten führt.
H Wasser absorbiert Infrarot-Strahlung
Die Wassermoleküle sind in sich hervorragend schwingungsfähig. Darauf beruht ihre
starke Absorptionsfähigkeit für IR-Strahlung. Das hat Folgen für das Klima
und für den Grund-Treibhauseffekt, der unseren Planeten Erde überhaupt bewohnbar macht.
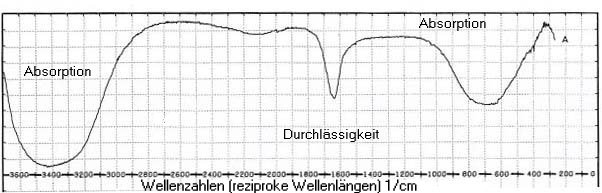 |
| Infrarotspektrum des Wassers |
Weitere Texte zum Thema „Wasser“