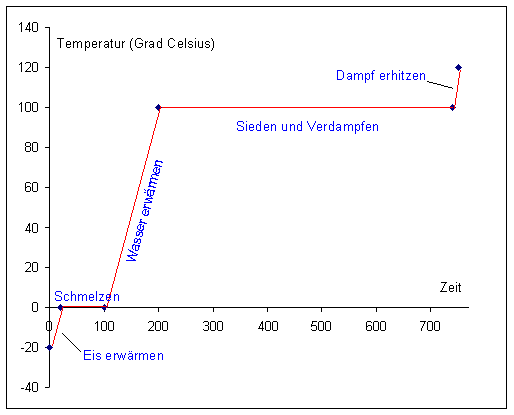
Der Temperaturverlauf beim Erhitzen des Wassersystems
Wenn man Wassereis unter konstanter Wärmezufuhr erhitzt und die Temperatur gegen die Zeit aufträgt, bekommt man den folgenden Kurvenverlauf.

Gehen wir von 1 kg Eis aus, das wir aus der Gefriertruhe nehmen. Es soll -20 °C
kalt sein.
Zunächst wird das Eis erwärmt. Die zugeführte Wärme DQ berechnen wir nach folgender Gleichung:
DQ = m • cp • Dt
m = Masse (kg)
cp = Wärmekapazität (kJoule/kg • grad)
t = Temperaturintervall (°C)
Die Wärmekapazität von Eis beträgt etwa 1,97 kJoule/kg • grad.
Damit wird DQ(Eis) = 1 • 1,97 • 20 = 39,4 kJoule
Nun verändert sich die Temperatur nicht mehr, weil sich Eis in flüssiges Wasser umwandelt. Wir sprechen von der Zufuhr einer latenten Wärme. Hier handelt es sich um die Schmelzwärme.
DH(Schmelzen) = 334,4 kJoule/kg
Man spricht von einem Phasengleichgewicht. Hier geht es um die Phasen Fest und Flüssig. Stoffe im Phasengleichgewicht sind Temperaturpuffer.
Wenn alles Eis geschmolzen ist, dient die weiter zugeführte Energie zur Erwärmung des Wassers, bis es zu sieden beginnt.
Die Wärmekapazität von Flüssigwasser beträgt etwa 4,19 kJoule/kg • grad. Sie ist größer als die von Eis, da das Wasser mehr Energie aufnehmen muss, um für eine gleiche Temperaturerhöhung erwärmt zu werden. Erklärung: Im Eis fangen die Moleküle nur an zu schwingen, bleiben aber zusammen; im flüssigen Wasser bewegen sie sich schon viel freier, müssen aber immer weiter voneinander getrennt werden.
Damit wird DQ(Flüssig) = 1 • 4,19 • 100 = 419 kJoule
Dann beginnt wieder ein Bereich, in dem die Temperatur nicht ansteigt. Wir führen diesmal die latente Siedewärme zu.
DH(Sieden) = 2261,8 kJoule/kg
Wir sehen, dass die Siedewärme viel größer ist als die Schmelzwärme. Das kann man damit erklären, dass ja anders als beim Schmelzen von Eis hier dafür gesorgt werden muss, dass die Moleküle wirklich voneinander getrennt werden. Das kostet natürlich Energie! Das erkennen wir in der Kurve auch daran, dass der Zeitraum des Siedens größer ist als der des Schmelzens.
Nun können wir noch annehmen, dass wir den Wasserdampf erwärmen – z. B auf 120 °C.
Die Wärmekapazität von Flüssigwasser beträgt etwa 1,89 kJoule/kg • grad.
Damit wird DQ(Dampf) = 1 • 1,89 • 20 = 37,8 kJoule
Die Bilanz der aufzuwendenden Energie ist
DQ(Gesamt) = DQ(Eis) + DH(Schmelzen) + DQ(Flüssig) + DH(Sieden) + DQ(Dampf)
DQ(Gesamt) = 3092 kJoule/kg
Das waren natürlich nur Überschlagsrechnungen. Denn die Wärmekapazität hängt auch noch von der jeweiligen Temperatur ab. Hinzu kommt, dass man um Wasser auf 100 °C zu erhitzen den Druck erhöhen muss. Die von uns verwendeten Wärmekapazitäten sind Werte für konstanten Druck.
Trotzdem kann man ja mal ausrechnen, was man dafür tun muss, um diese Energie zur Verfügung stellen zu können.
Z. B.: Wie viel Erdgas oder Kohle muss man dazu verbrennen? Wie lange muss der 1kWatt-Tauchsieder laufen?
Weitere Texte zum Thema „Wasser“