| Klick mich an! |
 |
2 Atombau und das Periodensystem der
Elemente (PSE)
| Klick mich an! |
 |
Abb. 2: Das Periodensystem der Elemente
(Unn bedeutet: Unnamed Element)
Atome besitzen eine definierte Masse und Größe. Sie bestehen aus
einem sehr kleinen, aber sehr schweren Kern und aus einer Hülle.
Der Atomkern enthält die Nukleonen, positiv geladene Protonen und
ungeladene Neutronen. Die Hülle enthält die entsprechende Anzahl
von negativ geladenen Elektronen.
Alle Elemente unterscheiden sich anhand der Protonenzahl. Diese heißt Ordnungszahl. Sie dient als Grundlage zur Ordnung der Elemente im Periodensystem (PSE; siehe Abb. 2). Abbildung 2 enthält die wesentlichsten Informationen zu den Elementen. Ausführliche PSE findet man im Internet, siehe z. B. das Periodensystem von Compuserve.
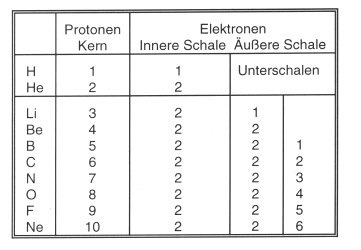
Formal wird von Element zu Element deren Kern um ein Proton und die Hülle um ein Elektron aufgefüllt. Letztere befinden sich auf definierten Schalen, die auch Orbitale genannt werden. Dieses Aufbauprinzip zeigt die Tab. 1 für die ersten 10 Elemente.

Tab. 1: Die ersten 10 Elemente
Im Periodensystem finden sich die Elemente nicht hintereinander aufgereiht, sondern in 8 Gruppen geordnet. Grundlage dieser Ordnung ist die frühe Beobachtung, da es untereinander verwandte Elemente gibt. Beispiele für solche Elementgruppen sind die Alkalimetalle oder Nichtmetalle wie die Halogene:
1. Gruppe (Alkalimetalle)
Die Elemente dieser Gruppe
7. Gruppe (Halogene)
Die Elemente dieser Gruppe
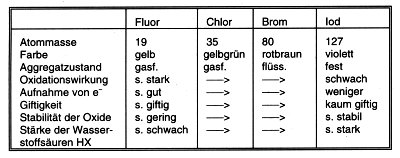
Innerhalb einer solchen Elementgruppe verändern sich die Stoffeigenschaften schrittweise, wie Tab. 2 am Beispiel der Halogene und Tab. 3 am Beispiel der Kohlenstoffgruppe zeigen.

Tab. 2: Eigenschaften der Halogene
Tab. 3: Eigenschaften der Kohlenstoffgruppe

Ordnet man nun die Elemente nach der Zahl der Protonen und zusätzlich nach ihren Eigenschaften, so erhält man das Periodensystem. Dieses ist horizontal in Perioden und vertikal in Gruppen eingeteilt.
Längs jeder horizontalen Periode werden, wie die Tab. 4 zeigt, die Schalen jeweils um ein Elektron aufgefüllt. Am Ende einer Periode steht jeweils ein Edelgas mit maximaler Anzahl von Valenzelektronen. Diese Schale ist sehr stabil. Danach wird mit dem Auffüllen einer neuen äußeren Schale, d.h. mit der nächsten Periode begonnen.
Ab der vierten Periode werden auch innere Schalen aufgefüllt. Man unterscheidet danach die Hauptgruppenelemente und die so genannten Nebengruppenelemente. Die Bezeichnung Nebengruppenelemente wird deren Bedeutung nicht gerecht, da sich hier die technisch, biologisch und ökologisch wichtigsten Metalle befinden. Beispiele sind die Münzmetalle, Platinmetalle, Chrom, Vanadin, Wolfram, Eisen, Nickel, Titan, Cadmium, Quecksilber, aber auch Uran und Plutonium. Man nennt sie deshalb besser Übergangsmetalle oder auch d- oder f-Elemente. (d und f bezeichnen innere Elektronenschalen.)
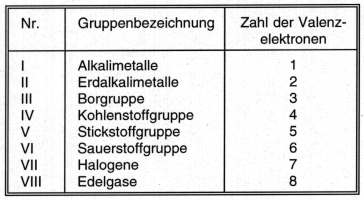
Die Elemente einer vertikalen Gruppe besitzen ähnliche chemische Eigenschaften, weil sie über die gleiche Anzahl von äußeren Elektronen, die sog. Valenzelektronen verfügen. Diese sind für die Chemie relevant, weil von ihnen die Bindungsverhältnisse abhängen. Die Anzahl der Valenzelektronen ist ein Ma für die maximale Wertigkeit des Elements und ist zugleich Nummer der betreffenden Elementgruppe (siehe Tab. 4).

Tab. 4: Elementgruppen im Periodensystem
Die meisten Elemente werden wie schon erwähnt in Metalle und Nichtmetalle unterteilt. Man zieht die Trennlinie im PSE längs Bor - Silicium - Tellur - Arsen - Astat. Diese Elemente haben zugleich metallische und nichtmetallische Eigenschaften und heißen deshalb auch Halbmetalle oder Metalloide. Sie sind von höchster technischer Bedeutung (Halbleitertechnologie, Elektronik).