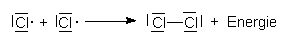
5 Radikale
Radikale sind Atome oder Moleküle mit freien, ungepaarten Elektronen. Sie spielen in der Umweltdiskussion vor allem im Zusammenhang mit den chemischen Prozessen in der Atmosphäre eine äußerst wichtige Rolle.
Es sei daran erinnert, dass Elektronenschalen von Atomen dann ganz besonders stabil sind, wenn sie eine gerade Zahl von Elektronen enthalten. Bei der Einrichtung von chemischen Bindungen findet der Austausch von Elektronen stets so statt, dass auch das gemeinsame Molekülorbital eine gerade Anzahl von Elektronen besitzt. Das können je nach Bindungsgrad 2 Elektronen (Einfachbindung), 4 (Doppelbindung) oder 6 (Dreifachbindung) sein.
Einzelne Atome wie die von Chlor oder Wasserstoff sind nicht stabil. Chlor enthält sieben Außenelektronen, also ein ungepaartes. Es ist so reaktiv, dass es sich bei Abwesenheit eines anderen Bindungspartners mit einem anderen Chloratom zu einem weniger reaktiven Chlormolekül verbindet:
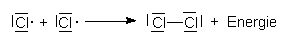
Eine Ausnahme ist das Sauerstoffmolekül. Es ist aus zwei Atomen mit gerader Valenzelektronenzahl aufgebaut. Energetische Gründe bei der Besetzung der möglichen Molekülorbitale führen dazu, dass das Sauerstoffmolekül ein hochreaktives Biradikal ist:
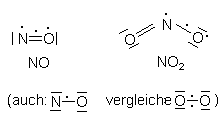
Weitere stabile, aber dennoch hochreaktive Radikalmoleküle entstehen zunächst, wenn Elemente mit gerader und ungerader Valenzelektronenzahl miteinander reagieren. Ein Beispiel hierfür sind die Stickoxide. Stickstoff (5 Valenzelektronen) und Sauerstoff (6) bilden die Stickoxide NO und NO2, die man unter der Bezeichnung NOx zusammenfasst. Sie haben beide mindestens ein freies Elektron, was sich in ihrer hohen Reaktionsbereitschaft in der belasteten Atmosphäre äußert.
Instabile Radikale entstehen durch Spaltung von Molekülen. Das kann durch Zufuhr von elektromagnetischer Strahlung (vor allem von UV-Strahlung wie in der Stratosphäre) erfolgen:
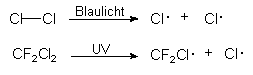
Möglich ist auch die Einwirkung von radioaktiver Strahlung. Ein Beispiel hierfür ist die Spaltung von Wasser in menschlichem Gewebe:
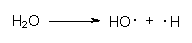
Die OH-Radikale (Hydroxyl genannt) können andere Moleküle unter Radikalbildung spalten, wobei in einer Kettenreaktion neuerliche Radikale oder giftige Peroxide entstehen:
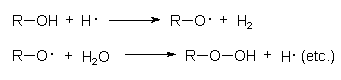
Die OH-Radikale können sich zu Wasserstoffperoxid zusammenlagern und sich dabei selbst eliminieren:
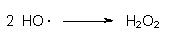
OH-Radikale entstehen auch durch Einwirkung von Ozon O3 auf Wasser:
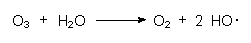
Sie sind wichtige Katalysatoren (-> 12) bei der Reinigung der belasteten Atmosphäre. Sie bilden sich in komplizierten Kreisläufen zurück und spielen beispielsweise bei der bodennahen Ozonbildung als Folge der Oxidation von Kohlenmonoxid CO eine zentrale Rolle (-> 10).
Typisch ist das Auftreten von Radikalen bei Verbrennungsprozessen. Hier wirken Radikale eher störend, da sie (wie etwa im Automotor) die Ausbildung einer gleichmäßigen Verbrennungsfront verhindern ("Klopfen"). Deshalb setzt man dem Benzin Radikalfänger (Scavenger) zu, die in der Hitze selbst leicht zerfallen und dabei Radikale bilden. Solche Verbindungen sind Isooctan oder Bleitetraethyl:
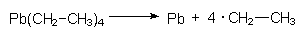
Isooctan hat die Formel:
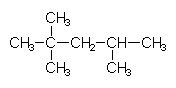
Diese Radikale reagieren mit den bei der Verbrennung entstandenen Radikalen unter Rekombination zu normalen Kohlenwasserstoffen, die weiter verbrannt werden können:
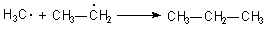
Eine weniger bekannte Möglichkeit zur Bildung von Radikalen ist die Reaktion mit Ionen, die anderen Verbindungen ein Elektron entreißen. Ein Beispiel hierfür ist das Eisen(III)-Ion Fe3+, das deshalb ein Oxidationsmittel ist (-> 13). Es kann mit labilen Verbindungen Radikale bilden:
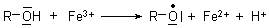
Hier ist ein Grund dafür zu sehen, dass Eisenverbindungen in höherer Konzentration durchaus toxisch sein können.