8 Energieumsatz bei chemischen Reaktionen
Zu der stofflichen Umwandlung kommt bei chemischen Reaktionen stets eine energetische Veränderung (Energieumwandlung). Wird Energie frei, spricht man von exothermen, im anderen Fall von endothermen Vorgängen. Bei umkehrbaren Reaktionen sind die Werte gleich. Hinzu kommt allerdings noch eine Aktivierungsenergie (-> 11.1).
Die wichtigsten Energieformen sind:
Wärme
Lichtenergie
Volumenarbeit
Die Zunahme eines Raumvolumens (Beispiel Motorzylinder) durch
eine chemische Reaktion, bei der sich aus festen oder flüssigen
Phasen (wie Sprengstoffe oder Benzin) Gase bilden, kann zur
Arbeitsleistung herangezogen werden.
Elektrische Energie
Chemische Bindungsenergie
Die freiwerdende Energie einer Reaktion ermöglicht eine andere,
gekoppelte Reaktion. Beispiele gibt es vor allem aus dem Bereich
der Biochemie. Kopplungsmolekül ist z. B. das ATP.
Die beschriebenen Energieformen können simultan umgesetzt oder ineinander umgewandelt werden. Sie sind allerdings von unterschiedlicher ökonomischer und ökologischer Wertigkeit. Von niedriger Wertigkeit sind Wärme und explosionsartige Volumenarbeit. Von höchster Wertigkeit sind elektromagnetische Strahlung, chemische Bindungsenergie und elektrische Energie. Man nennt sie auch "Freie Energie". Sie können zum größten Teil biochemisch oder technisch genutzt werden. Prozesse können so geführt werden, dass das Verhältnis von minderwertiger zu hochwertiger Energie variiert. Ein Maß hierfür ist der Wirkungsgrad.
Ein Beispiel hierfür ist die Reaktion zwischen Wasserstoff und Sauerstoff. Lässt man beide Gase ungeregelt reagieren, so gibt es die Knallgasexplosion, bei der kaum technisch verwertbare Energie anfällt.
In speziellen Brennkammern kann man beide Gase kontrolliert miteinander reagieren lassen. Dies ist der Fall bei Raketenmotoren wie dem der Spaceshuttles. Versagt diese Kontrolle, obsiegt wieder die ungehemmte Wärmefreisetzung (Challenger-Unglück). Auch die Entwicklung der Technologie des Antriebs von Verbrennungsmotoren, die mit Wasserstoff anstelle von Benzin angetrieben werden, geht ähnliche Wege. (Die "Wasserstoffgesellschaft" ist aus technischen und ökonomischen Gründen allerdings wohl noch in weiter Ferne.)
Die Reaktion zwischen Wasserstoff und Sauerstoff beruht auf einem Austausch der Elektronen zwischen den Atomen. Lässt man die Gase an katalytisch wirkenden Metallflächen getrennt reagieren, so gibt H2 seine Elektronen an diese ab, O2 nimmt die gleiche Menge heraus. Die Folge ist ein elektrischer Strom (-> 13; Brennstoffelement). Hier findet man Energieausbeuten (Wirkungsgrade) nahe bei 100 %.
Die schrittweise Oxidation in der Atmungskette ist ebenfalls ein solches ökonomisches Energieumwandlungssystem. Hier wird das Potential der Elektronen des Wasserstoffs stufenweise als chemische Energie abgefangen und letztlich auf Sauerstoff übertragen. Energieträger ist das schon erwähnte ATP. Die Ausbeute liegt bei 60 %.
Wertvolle Energie wird nach mehrfachem Gebrauch durch Reibungsverluste entwertet und letztlich zu "Wärmemüll". Gleiches gilt von vornherein für Überschussenergien, die aus Gründen der Aktivierung nötig sind.
Wärme bedeutet u. a. ungeregelte Bewegung von Atomen und Molekülen, also Unordnung. Ein Maß für diesen nicht vollständig zurückgewinnbaren Energieanteil ist die Entropie.
Entropie bedeutet Verlust an Arbeit. Diesen Verlust möglichst gering zu halten, ist die Aufgabe eines großen Bereichs der Technik - z. B. der Strömungstechnik oder Schmierölchemie. Kühlkreisläufe in Heizkraftwerken werden immer ausgefeilter. Restwärmen werden nach dem Prinzip der Kraft-Wärmekopplung minimiert und wirtschaftlich ausgeschöpft. Ein Wirkungsgrad von 100 % lässt sich aus prinzipiellen Gründen für technische Zwecke aber niemals erreichen, da zur Arbeitsfähigkeit immer ein Potential bestehen bleiben muss.
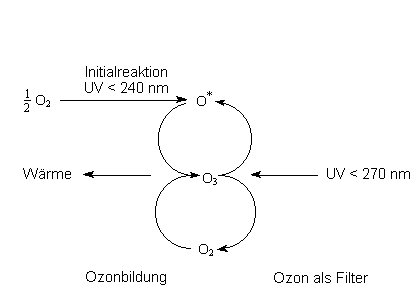
Allerdings ist zumindest ein Beispiel der Entwertung von Energie von größter Bedeutung für das irdische Leben: Im Ozongürtel der Stratosphäre wird potentiell hochwertige UV-Strahlung durch Ozonmoleküle absorbiert und in chemische Energie verwandelt, indem das Molekül O3 gespalten wird. Die Rekombination der so gebildeten Sauerstoffatome und -moleküle erfolgt unter Freisetzung von Wärme:
