10 Reaktionskinetik
Die Reaktionskinetik untersucht den zeitlichen Ablauf von chemischen Reaktionen.
Jede chemische Reaktion bedarf einer gewissen Zeit, bis sie beendet ist oder ein Gleichgewicht erreicht hat. Die Zeitspannen sind sehr unterschiedlich. Z. B. erfolgt innerhalb von 10¯14 Sekunden die Neutralisation von H+- durch OH¯-Ionen. Der Abbau von Dioxinen auf 50 % der gegenwärtigen Konzentration benötigt 160 Jahre.
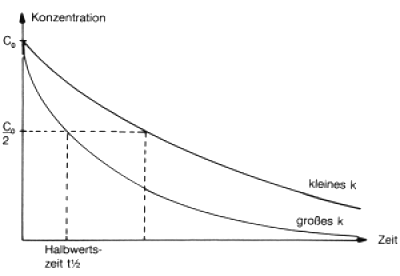
Verfolgt man den zeitlichen Verlauf der Konzentrationen der an der Reaktion beteiligten Stoffe, so erhält man exponentielle Kurven. Bei Verschwinden eines Stoffes resultiert eine Abklingkurve (-> Abb. 20), im Falle der Bildung eine spiegelbildliche Sättigungskurve.

Abb. 20: Konzentrations/Zeit-Kurven einer chemischen Reaktion
Man definiert als ein Maß für die Änderung
der Konzentration c eines verschwindenden Stoffes mit der Zeit t die Reaktionsgeschwindigkeit
RG. Z. B. wird ein Giftstoff ausgeschieden oder im Boden abgebaut.
Das Konzentrations/Zeitgesetz lautet in diesem Fall:
c = Konzentration zur Zeit t
c0 = Anfangskonzentration
(Die gleichen Überlegungen gelten auch, wenn man anstelle von t die Zahl der Reinigungsschritte als Parameter wählt, die notwendig sind, um einen Schadstoff aus einem belasteten Medium beispielsweise durch Extraktion zu entfernen.)
Die Geschwindigkeitskonstante k ist ein Maß für den Abbau und damit auch für die Persistenz (d.h. die umweltchemische Verfügbarkeit) des betreffenden Stoffes. Je größer der Wert von k ist, desto rascher zerfällt der Stoff.
Die Zeit, nach der die Hälfte des Stoffs abgebaut ist, heißt Halbwertszeit t½. Die Halbwertszeit von Formaldehyd beträgt in der Atmosphäre etwa einen halben Tag, die von TCDD im Boden dagegen 160 Jahre. Als Faustregel gilt, dass man 10 Halbwertszeiten benötigt, um den Schadstoff auf 1 Promille der Anfangskonzentrationen zu reduzieren.
Die Halbwertszeit hängt mit der Konstante k zusammen:
t½ und k sind demnach umgekehrt proportional, d.h. je größer k ist, desto kleiner ist die Halbwertszeit (vgl. Abb. 20).
Halbwertszeiten definiert man auch für den radioaktiven Zerfall von Isotopen. Die Halbwertszeit von Radon-209 beträgt 30 min, von Strontium-90 28,1 Jahre, von Plutonium-239 24.400 Jahre und von Kalium-40 1,28 · 109 Jahre. (Radon wird von gewissen Baustoffen oder Böden emittiert (Wismut-AG). Strontium entsteht als Produkt der Kernspaltung. Plutonium wird künstlich im Brüter aus Uran gewonnen und dient als Reaktorbrennstoff oder zur Herstellung von Nuklearwaffen. Kalium wird aus Kohlekraftwerken emittiert und wandelt sich in das Edelgas Argon um.)
Man entnimmt diesen Zahlen übrigens auch, dass das giftigste Dioxin, das TCDD, fünfmal stabiler ist als etwa Strontium-90.
Sind an der Abbaureaktion mehr Substanzen als der betreffende Stoff beteiligt, so gehen auch deren Konzentrationen in die Reaktionsgeschwindigkeit ein. Ein Beispiel sind die OH-Radikale, die als Reinigungsmittel der Atmosphäre bei der Oxidation von Schadstoffen wie Kohlenmonoxid CO zu CO2 mitwirken:
Je mehr davon in der Atmosphäre sind, desto schneller erfolgt der Abbau der Schadstoffe. Da der atmosphärische Gehalt an OH-Radikalen im Allgemeinen konstant ist, definiert man eine neue Geschwindigkeitskonstante:
Man kann die Umsatzrate von atmosphärischen Schadstoffen auch direkt durch die Konzentration der OH-Radikale cOH beschreiben.
Einige genauere Erörterungen zur Reaktionskinetik
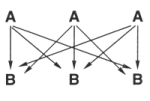
1. Hinter der Formulierung der RG-Gleichungen und den Produkten der Konzentrationen der beteiligten Stoffe stecken stochastische Überlegungen. So gibt es bei je drei Molekülen eines Stoffs A mit einem anderen B neun (also 3 · 3) zum Erfolg führende Stoßmöglichkeiten:
Das macht Voraussagen für Laien wenig übersichtlich oder einsichtig, wie das Beispiel des Ozonabbaus durch Chloratome zeigen kann. Man hat festgestellt, dass die Verdopplung der Konzentration der direkt beteiligten Chloratome nicht zur Verdopplung der Geschwindigkeit des Ozonabbaus, sondern zu wesentlich rascherem Abbau führt. Der Grund:
Statt
heißt es
Der Vergleich der RG-Werte für die Vergrößerung von CCl = 1 auf CCl = 2 zeigt dies deutlich:
Falsch:
Richtig:
2. Die Gleichungen gestatten auch zu berechnen, nach wie vielen Halbwertszeiten eine einmalig aufgenommene Menge eines Schadstoffs auf 1 Promille zurückgegangen ist (oder ein Radionuklid entsprechend zerfallen ist):
Man führt die Halbwertszeit ein (k = ln 2/t½) und logarithmiert:
Mit ln 1000 = 6,93 und ln 2 = 0,693 folgt:
Erst nach 10 Halbwertszeiten ist ein Schadstoff auf 1 Promille seiner Anfangskonzentration abgebaut.
3. Aber auch Gleichgewichtssysteme kann man untersuchen. Ein typisches Beispiel stammt aus der Toxikologie, bei dem man mit kinetischen Überlegungen den voraussichtlichen Sättigungswert von Schadstoffen wie den Dioxinen berechnen kann.
Problem: Der ADI-Wert für den Menschen liegt bei 1 pg TE/kg LG. Gleichzeitig werden die Dioxine aber ausgeschieden; die Halbwertszeit t½ beträgt hierfür 5 Jahre. Daraus wird sich irgendwann einmal ein Gleichgewicht mit einer Sättigungskonzentration ergeben. Wie groß ist diese?
Der Ansatz ist:
Der Sättigungswert wird im Gleichgewichtszustand erreicht. Hier ist RG = 0. Daraus folgt:
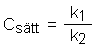
Für den konkreten Fall von Dioxin gilt:
Die Sättigungskonzentration ist mit diesen Werten:
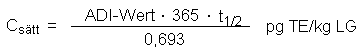
Die Beziehung gestattet, rasch zu überschlagen, was es bedeutet, wenn der ADI erhöht wird und/oder die Halbwertszeit doch größer ist als vermutet.
Unter den Bedingungen (Aufnahme: ADI = 1 pg/Tag und kg LG und Ausscheidung: t½ = 5 Jahre) findet man den bekannten Literaturwert von 3 000 pg TE/kg LG:
Diskutiert wird z. B. die Erhöhung des ADI auf 10 pg/Tag und kg LG. Kalkuliert man realistischerweise eine größere Halbwertszeit von 10 Jahren mit ein, so erhält man