
13 Oxidation und Reduktion
In diesem Abschnitt werden die Elektronenaustauschreaktionen besprochen. Sie sind von großem technischen und ökologischen Interesse.
13.1 Oxidation
Der klassische Oxidationsbegriff
Früher war Oxidation eine chemische Reaktion unter Beteiligung von Sauerstoff. So verbrennt
Magnesium unter Abgabe von Wärme, intensiv weißem Licht und UV-Strahlung zu einem weißen Pulver,
Magnesiumoxid:
Die Eigenschaften der Stoffe (Mg: Metall, O2: Gasförmiges Nichtmetall) sind nach der Reaktion nicht mehr vorhanden. MgO ist weder ein Gas noch ein Metall, sondern ein ionisch aufgebauter Festkörper. (Magnesiumoxid hilft unter der Bezeichnung Magnesia dem Turner zur Vermeidung von Reibungsverlusten am Reck.)
Fester, geruchloser Schwefel verbrennt zu einem gasförmigen, stechend riechenden Oxid, Schwefeldioxid:
Gasförmiger Wasserstoff bildet das Oxid Wasser:
Kohlenstoff verbrennt bei Sauerstoffmangel zu Kohlenmonoxid CO:
Allgemein gilt für die exotherme Oxidationsreaktion:
(Ausnahmen gibt es vor allem bei der Oxidation von Nichtmetallen. So ist die Bildung von NO aus Stickstoff und Sauerstoff stark endotherm. Grund sind die hohe Stabilität von Stickstoff und die geringe EN-Differenz. Weitere Beispiele hierzu siehe -> 13.3.)
Oxidation muss nicht immer mit Flammenerscheinung verbunden sein. Eisenwolle reagiert mit Sauerstoff und Wasser langsam zu Rost (Eisenoxid-hydroxid):
Die Bindungsverhältnisse bei den Oxiden sind unterschiedlich. In Metalloxiden liegen Ionen vor, während bei den Nichtmetalloxiden der kovalente Bindungsanteil vorherrscht (-> Abb. 28):
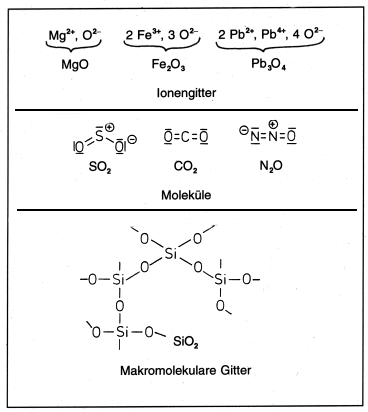
Abb. 28: Strukturen von Metall- und Nichtmetalloxiden
Anders als bei der Säure/Base-Neutralisation (-> 14.9) hängt die Energiemenge von der Art des
oxidierten Stoffs ab (-> Tab. 12). Dies liegt an den unterschiedlichen Elektronegativitäten der
Elemente, d. h. mit welcher Vehemenz die Elemente Elektronen zu sich heranziehen oder abgeben (->
Tab. 6; 4.1). In diesem Zusammenhang sei auch auf die sog. Spannungsreihe der Elemente verwiesen
(-> Tab. 13; 13.7.1).
| Tab. 12: Oxidationsenthalpien verschiedener Elemente | ||
| Element | Oxid | Oxidationsenthalpie H1) |
| U | UO2 | –1101,472) |
| Al | Al2O3 | –846,55 |
| P | P4O10 | –745,32 |
| Mg | MgO | –603,74 |
| C | CO2 | –392,60 |
| Zn | ZnO | –345,77 |
| S | SO2 | –297,41 |
| Fe | FeO | –273,69 |
| Pb | PbO | –218,05 |
| Na | Na2O | –209,25 |
| Cu | CuO | –158,13 |
| H | H2O | –147,9 |
| Hg | HgO | –91,17 |
| Ag | Ag2O | –16,22 |
| Au | Au2O3 | –4,53 |
1) KJoule/Mol des Elements
2) Dieser hohe Wert ist der Grund für den Einsatz von feinst zerteilten Uranabfällen in Uran-Brandbomben.

Der erweiterte Oxidationsbegriff
Eine andere Betrachtungsweise der Oxidation ergibt sich aus der Beobachtung, dass Eisenwolle nicht
nur in Sauerstoff, sondern auch in Chlorgas verbrennt. Dabei bildet sich gelbes Eisenchlorid:
Wie beim Eisenoxidhydroxid liegen auch hier Fe3+-Ionen vor, die neben Chlorid-Ionen Cl¯ in ein Kristallgitter eingebettet sind.
Nach moderner Auffassung ist Oxidation deshalb mehr als nur die Aufnahme von Sauerstoff. Oxidation ist die Abgabe von Elektronen. Beispiele sind:
(Die beiden letzten Gleichungen sind nur formal, da bei den kovalent gebundenen Oxiden die Elektronen in die Molekülorbitale des Oxids eingebaut werden.)
Der oxidierte Stoff ist somit Elektronendonator. Es muss sich nur etwas finden, was die Elektronen aufnimmt, also einen Elektronenakzeptor, hier Sauerstoff oder Chlor.
13.2 Reduktion
Der klassische Reduktionsbegriff
Reaktionen, bei denen Sauerstoff aus einem Oxid entrissen wird, sind Reduktionen. Das gelingt bei edleren
Metallen durch Umkehrung der Bildungsreaktion der Oxide, indem man die Oxide erhitzt:
(Im Schullabor setzt man stattdessen Silberoxid ein.)
Ein anderes Beispiel ist die Gewinnung von Blei aus Bleioxid mit dem Reduktionsmittel Kohlenstoff:
Bleioxid gibt den Sauerstoff an Kohlenstoff ab und wird somit zum Element Blei reduziert.
Bei der Reduktion wird die Masse der Substanz verringert. Ein Beispiel ist die Reaktion von Kupferoxid mit dem Reduktionsmittel Wasserstoff:
1 Mol CuO wiegt 79,5 g, das gebildete Mol Kupfer nur 63,5 g.
Der erweiterte Reduktionsbegriff
Reduktion ist nicht nur die Abgabe von Sauerstoff. Reduktion ist die Aufnahme von Elektronen.
13.3 Redoxreaktionen
Der Austausch von Elektronen setzt einen Donator und einen Akzeptor voraus. Eine Oxidation geht immer mit einer Reduktion einher. Man nennt den gesamten Vorgang daher Redoxreaktion (oder auch R/O-Reaktion).
Ein Elektronendonator ist ein Reduktionsmittel. Es wird bei Redoxreaktionen oxidiert.
Ein Elektronenakzeptor ist ein Oxidationsmittel. Es wird bei Redoxreaktionen reduziert.
Ob ein Stoff Oxidationsmittel oder Reduktionsmittel ist, entscheidet letztlich der Reaktionspartner und das Verhältnis der Elektronegativitäten (EN; -> 4.1).
Ob Redoxreaktionen mit oder ohne Energiezufuhr ablaufen können (abgesehen von Aktivierungsenergien), entscheidet die Differenz der Oxidationsenthalpien der beteiligten Elemente (Beispiel: Thermitverfahren).
Hierzu sollen die Reaktionen der drei Metalle Silber, Kupfer und Zink und ihrer Salze betrachtet werden. Solche Reaktionen spielen bei der Metallgewinnung eine wichtige Rolle (Zementieren).
Metallisches Kupfer setzt als Reduktionsmittel aus Silbersalzlösungen metallisches Silber frei und wird dabei selbst zu Kupfersalz oxidiert. Kupferionen oxidieren ihrerseits Zink. Deshalb setzt Zink aus Kupfersalzen Kupfer frei, wobei es selbst zu Zinksalz aufgelöst wird:
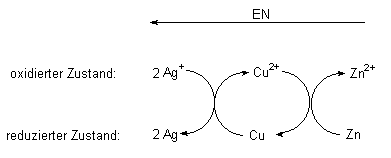
Man kann alle Elemente aufgrund solcher Experimente in eine Reihe ordnen: Spannungsreihe der Elemente (-> Tab. 13 - 15; 13.7.1).
Klassische Reduktionsmittel
sind Elemente mit niedriger EN und Verbindungen mit niedriger Oxidationszahl:
Klassische Oxidationsmittel
sind Elemente mit höherer EN. Ihre Verbindungen mit hoher Oxidationszahl sind weniger stabil:
Umgebungen, in denen Reduktionsmittel vorherrschen, nennt man reduzierend oder anoxisch. Beispiele sind eutrophierte, umkippende Gewässer wie die Ostsee unterhalb der Sprungschicht von 14 m oder Prozesse in den MVA.
Redoxneutrale sowie oxidierende Umgebungen sind sauberes, kühles Wasser, aber natürlich auch die Atmosphäre.
13.4 Begriff der Wertigkeit. Oxidationszahlen
Die Menge der abgegebenen oder aufgenommenen Elektronen nannte man früher Wertigkeit des Elements. Heute spricht man stattdessen von Oxidationszahl.
Elemente haben die Oxidationszahl 0. Das Vorzeichen der Oxidationszahlen richtet sich nach der Richtung der Elektronenwanderung oder der EN. Metalle haben in Verbindungen stets positive Oxidationszahlen.
Die Oxidationszahl bezieht man am einfachsten auf Wasser. Ein Atom von Sauerstoff verbindet sich mit zwei Atomen Wasserstoff. H gibt ein Elektron ab, lädt sich somit positiv auf und hat die Oxidationszahl +I, Sauerstoff nimmt zwei Elektronen auf, lädt sich zweifach negativ auf. Seine Oxidationszahl ist -II.
Die Summe der Oxidationszahlen in einer Verbindung muss 0 sein. Z. B.: In KMnO4 hat K +I, die 4 O-Atome 4 x (-II) = -VIII. Das Mangan hat dann die Oxidationszahl +VII.
Viele Elemente haben je nach Bindungszustand mehrere Oxidationszahlen. So kann Kohlenstoff z. B. zwei oder vier Elektronen abgeben. Dabei bilden sich CO oder CO2:
C + O2 ————> CO2 + Energie
Verbrennt man Kupfer unter Sauerstoffüberschuss, so erhält jedes Cu-Atom ein O-Atom. Dieses Cu-Atom ist zweiwertig und hat die Oxidationszahl +II. Man spricht von Kupfer(II)-oxid:
Ist das Sauerstoffangebot geringer, müssen sich zwei Cu-Atome ein O-Atom teilen. Diese Cu-Atome sind einwertig, haben also die Oxidationszahl +I. Man spricht von Kupfer(I)-oxid:
Gleiches gilt auch für das Eisen. Es gibt Eisen(II)- und Eisen(III)-Verbindungen. Erstere sind z. B. in der frischen Dünnsäure enthalten. Sie haben die Tendenz, sich in das stabilere Eisen(III) umzuwandeln; damit verbrauchen sie Sauerstoff als Elektronenakzeptor und beeinflussen die lebenswichtige Sauerstoffbilanz der belasteten Gewässer:
Stickstoff hat in Ammoniak NH3 die Oxidationszahl -III, in Stickstoffdioxid NO2 +IV. Ersteres findet man in reduzierender, zweites in oxidierender Umgebung.
13.5 Formulierung von Redoxgleichungen
Man kann Redoxgleichungen leicht aufstellen, indem man die Reduktion und die Oxidation formal getrennt beschreibt. Oft gibt man auch nur die Reduktions- oder Oxidationsgleichung an, ohne das zugehörige Donator/Akzeptor-System zu berücksichtigen. Einzelne Beispiele:
1. Sauerstoff reagiert mit Wasserstoff zu Wasser.
Reduktion: O2 + 4 e¯ ————>
2 O2¯
Oxidation: 2 H2 ————>
4 H+ + 4 e¯
2. Schwefel bildet mit Zink Zinksulfid.
Reduktion: S + 2 e¯ ————>
S2¯
Oxidation: Zn ————>
Zn2+ + 2 e¯
3. Eisenmetall fällt aus Kupferlösungen Kupfermetall, reduziert dieses also und geht dabei selbst in Lösung, d. h. Eisen wird oxidiert. Dieser Vorgang dient zur Anreicherung von Kupfer nach dem Zementierungsverfahren.
Reduktion: Cu2+ + 2 e¯ ————> Cu
Oxidation: Fe ————> Fe2+ + 2 e¯
4. Kohlenmonoxid weist man durch Oxidation mit Silbernitrat in basischer Lösung nach. Basisches Milieu ist notwendig, um die entstehenden Protonen aus dem Gleichgewicht abzufangen und es damit zu verschieben.
Reduktion: Ag+ + e¯ ————> Ag (x 2)
Oxidation: CO + H2O ————> CO2 + 2 H+
+ 2 e¯
(Das Oxidationsmittel von CO zu CO2 ist also Ag+ und nicht Sauerstoff. Das zweite Sauerstoffatom im CO2 stammt aus dem Wasser, wo es bereits mit der Oxidationszahl II vorliegt. Dies ist ein typischer Weg zur Einfügung von Sauerstoffatomen in wässrigem und reduzierendem Milieu wie z. B. in einer lebenden Zelle.)
Ähnliche Redoxreaktionen sind Grundlage der fotographischen Entwicklung. Reduktionsmittel des lichtempfindlichen Silberbromids sind z. B. Hydrochinon und ähnliche Verbindungen wie Phenylendiamin (-> 16.2).
5. Ein kompliziertes Beispiel: Zur Ermittlung des Chemischen Sauerstoffbedarfs COD wird die angesäuerte Wasserprobe mit dem Oxidationsmittel Kaliumpermanganat (+VII) versetzt. Als Beispiel soll Oxalsäure oxidiert werden:
Reduktion: MnO4¯ + 8 H+ + 5 e¯
————> Mn2+ + 4 H2O
Oxidation: HOOC-COOH ————>
2 CO2 + 2 H+ + 2 e¯
6. Ein wichtiges Beispiel ist Wasserstoffperoxid H2O2. Gegenüber starken Reduktionsmitteln wie Schwefelwasserstoff (II) und in basischem Milieu wirkt es zunächst oxidierend:
Reduktion: H2O2 + 2 e¯
————> 2 OH¯
Oxidation: H2S + 2 OH¯ ————>
S + 2 H2O + 2 e¯
Gegenüber starken Oxidationsmitteln wie Chromat (+VI) und in saurem Milieu wirkt es dagegen reduzierend:
Reduktion: CrO42¯ + 8 H+ ————>
Cr3+ + 4 H2O + 3 e¯
Oxidation: H2O2 ————>
2 H+ + O2¯ + 2 e¯
In Gegenwart von Katalysatoren (-> 12.2) wirkt H2O2 zugleich als Reduktions- und als Oxidationsmittel, indem es sich selbst zersetzt:
Reduktion: H2O2 + 2 e¯ ————> 2 OH¯
Oxidation: H2O2 ————> 2 H+ + O2 + 2 e¯
(Sauerstoff-Entwicklung in Abwässern.)
13.6 Symproportionierung und Disproportionierung
Hierunter versteht man Redoxreaktionen, an deren Redoxprozess nur ein Element in zwei Oxidationsstufen beteiligt ist. Ein Beispiel war die eben bereits erwähnte Selbstzersetzung von H2O2:
Chlor (0) disproportioniert mit Wasser unter Bildung von Chlorid (I) und Hypochlorit (+I). Gibt man umgekehrt zu Natriumhypochlorit Salzsäure, bildet sich unter Symproportionierung Chlor zurück (Domestos-Problem; -> 11.1):

Bei dem Denox-Verfahren zur Rauchgasentstickung reagieren die Stickoxide (z. B. NO (+II)) mit Ammoniak (III) zu Stickstoff (0):
Ähnlich verläuft die Redoxreaktion zwischen SO2 (+IV) und H2S (II) beim Clausprozess zur Abgasentschwefelung:
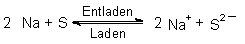
Ein weiteres Beispiel ist die Technik der Akkumulatoren. Der Ladevorgang eines Bleiakkus ist eine Disproportionierung, der Vorgang beim Entladen eine Symproportionierung:

(Vgl. auch Abb. 32.)
13.7 Maßzahlen für Redoxpotentiale
Maßzahlen für Sauerstoffgehalt oder Oxidationsfähigkeit bzw. Redoxlage eines Mediums sind der BOD- oder der COD-Wert (Werte für den biologischen bzw. chemischen Sauerstoffbedarf). Diese werden heute mehr und mehr durch Kenngrößen wie Redoxpotential oder mehr noch durch den rH-Wert, der sog. Reduzierfähigkeit des betrachteten Redoxsystems, ersetzt. Diese scheinen relativ fiktive Zahlen zu sein. Aber man gewöhnt sich an sie genauso rasch wie an den pH-Wert oder an den Umgang mit Dezibel.
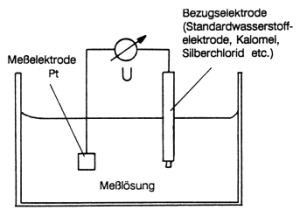
Abb. 29: Messanordnung zur Bestimmung von Redoxpotentialen
13.7.1 Redoxpotential. Standardpotential
In der Chemie beschreibt man die Lage eines wässrigen Redoxsystems durch sein Redoxpotential, einen Spannungswert. Diesen bezieht man auf eine andere, wohldefinierte Elektrode (-> Abb. 29). Üblich ist die Standardwasserstoffelektrode, deren Potential man aus gutem Grund (-> S. 95) gleich Null setzt. Deren Redoxgleichgewicht ist:
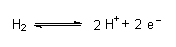
(Man verwendet aus praktischen Gründen feste Elektroden wie die Silber/Silberchlorid- oder die Kalomelelektrode, muss dann allerdings das gemessene Potential um deren Eigenpotential korrigieren.)
Die Standardpotentiale, d. h. das Redoxpotential eines beliebigen wässrigen Redoxsystems bei der Konzentration 1 mol l¯1, findet man tabelliert in der Spannungsreihe der Elemente (-> Tab. 13, 14). Die positiven Standardpotentiale bedeuten eher Oxidationsmittel, die negativen eher Reduktionsmittel. Dies ist natürlich nur relativ zu sehen. So kann man nachträglich die Reihe Silber-Kupfer-Zink verstehen.


Saure Lösung (aH+ = 1 mol l¯1)
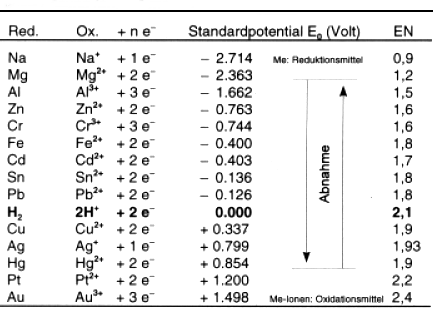
Dieser Tabelle entnimmt man wichtiges für den Bau von Batterien:
Jeder Metallstab gibt in Wasser getaucht Metall-Ionen ab, der eine mehr, der andere weniger.

Tab. 14: Spannungsreihe einiger Nichtmetalle (Wasser, 25 °C)
Saure Lösung (aH+ = 1 mol l¯1)
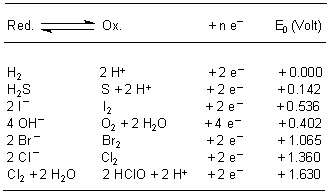
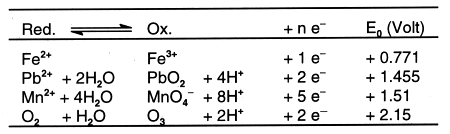
Eine Spannungsreihe lässt sich natürlich auch für reduzierende oder oxidierende Ionen bzw. Verbindungen aufstellen (-> Tab. 15).

Tab. 15: Spannungsreihe einiger Verbindungen und Ionen (Wasser, 25 °C)
Saure Lösung (aH+ = 1 mol l¯1)
Der Grund, dass gerade Wasserstoff als Nullpotential definiert wird, liegt darin, dass Metalle mit negativerem Potential H+ reduzieren (entladen), sich also unter Wasserstoffentwicklung in Säuren lösen (unedle Metalle). Wir verstehen nun auch die Auflösung von Metallen durch Säuren als Redoxprozess:
Reduktion: 2 H+ + 2 e¯ ————> H2
Oxidation: Zn ————> Zn2+ + 2 e¯
Für Metalle mit positiverem Potential (edlere Metalle) reicht die Oxidationskraft der H+-Ionen nicht aus. Sie lösen sich deshalb nicht in Wasserstoffsäuren unter Wasserstoffentwicklung, sondern benötigen stärker oxidierende Systeme wie den oxidierten Stickstoff in der konzentrierten Salpetersäure:
Das Redoxpotential hängt von folgenden Parametern ab:
Den formalen Zusammenhang gibt die Nernstsche Gleichung für 25 °C:
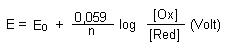
Bei Festkörpern setzt man deren Konzentration gleich Eins. Bei der Beteiligung von Gasen wird die Konzentration als Partialdruck z. B. pH2 oder pCl2 angegeben.
Damit ist z. B. das Redoxpotential von Kupfer in einer Kupfersalzlösung:
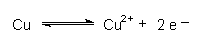
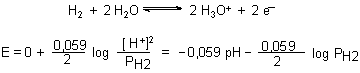
Die Standardwasserstoffelektrode hat die Konzentration [H+] = 1 und den Druck 1 bar. Damit ist E = 0 Volt.
13.8 Redoxprozesse an getrennten Orten. Elektrochemie
Da die oben demonstrierte Herleitung von Redoxgleichungen durch Zerlegung in einen Reduktions- und einen Oxidationsteil nicht nur formale Bedeutung hat, sondern auch praktische, zeigt die Chemie der Galvanischen Elemente und der Elektrolyse. Hier verlaufen die Reduktion und Oxidation an getrennten Orten ab. Der Elektronenfluss wird über einen äußeren Leiter geführt und kann im Fall der Galvanischen Elemente zur Gewinnung von hochwertiger elektrischer Arbeit dienen.
Der Pol, an dem oxidierende Vorgänge ablaufen, ist die Anode. Der Pol mit Reduktionsprozessen ist die Kathode. Mit diesen Bezeichnungen wird noch nichts über das Vorzeichen der Polung ausgesagt.
13.8.1 Galvanische Elemente
Batterien
Schaltet man einen Kupfer- gegen einen Eisenstab, die beide jeweils in ihre Salzlösungen getaucht werden, so baut
sich zwischen beiden Elektroden eine Spannung auf (-> Abb. 30). Verbindet man sie, so fließt ein Strom. Dabei beobachtet
man, dass sich Kupfer aus der Kupfersalzlösung auf der Kupferelektrode niederschlägt: Pluspol, während sich gleichzeitig
die Eisenelektrode auflöst. Wir haben es hier mit einer einfachen Batterie zu tun.
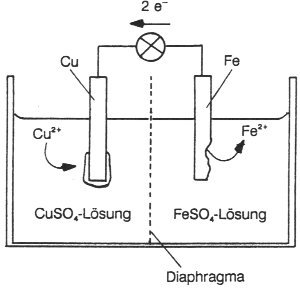
Abb. 30: Galvanisches Element (Cu/Fe)
Dieser Vorgang ist zugleich aber auch die chemische Grundreaktion der Korrosion. Hierbei handelt es sich um den
Redoxausgleich zwischen kurzgeschlossenen Metallen unterschiedlicher Elektronegativität, die zur Auflösung des unedleren
Metalls (hier Eisen) führen.
Akkumulatoren
Wenn der spannungsliefernde Vorgang reversibel ist, spricht man von Akkumulatoren. Ein modernes Beispiel ist die
neue, im Gegensatz zum Bleiakkumulator sehr leichte Natrium-Schwefel-Zelle, bei der die nach rechts ablaufende Redoxreaktion
bei höherer Temperatur Strom liefert:
Die Rückreaktion kann man erzwingen, indem man eine äußere Spannung anlegt. Dies geschieht durch Elektrolyse (-> 13.8.2).
Brennstoffzellen
Nutzt man Oxidationsprozesse aus, die normalerweise als Verbrennungen ablaufen, so erhält man die Brennstoffzelle wie
z. B. die Knallgaszelle:
In einem Elektrolyten befinden sich zwei Edelmetallelektroden, die durch ein Diaphragma getrennt sind. Man bläst über die eine Elektrode Wasserstoffgas, über die andere Sauerstoff. Es finden die bekannten Redoxreaktionen statt:
Anode (Oxidation): 2 H2 ————>
4 H+ + 4 e¯ (Minuspol)
Kathode (Reduktion): O2 + 2 H2O + 4 e¯
————> 4 OH¯ (Pluspol)
(Wir sehen hier, dass diese Einzelgleichungen mehr als nur formalen Charakter haben.)
Die Edelmetallelektroden spielen die Rolle eines Kontaktkatalysators. Elektrolyt ist im Allgemeinen Kalilauge. Damit werden die Protonen weggefangen, die den Prozess hemmen.
Als Reduktionsmittel eignen sich auch Kohlenwasserstoffe, Methanol und Ethanol.
Red.: O2 + 2 H2O + 4 e¯
————> 4 OH¯ (Pluspol)
Ox.: CH3OH + H2O ————>
CO2 + 6 H+ + 6 e¯ (Minuspol)
Problematisch ist hierbei vor allem die Entwicklung guter Katalysatoren, so dass die Technik noch nicht allzu ausgefeilt ist.
13.8.2 Die Elektrolyse
Cäsiumfluorid ist eine bemerkenswert stabile Substanz. Das Salz entsteht aus der Reaktion zwischen Elementen extremer EN.
| - |
Das stärkste chemische Oxidationsmittel, das man kennt, ist Fluor (EN 4,0).
Es kann die anderen Halogene aus deren Bindungszustand als Halogenide befreien; z. B.:
Mit welchem Reduktionsmittel befreit man aber Fluor aus seinem anionischen edelgasartigen Bindungszustand Fluorid F ¯? |
| - |
Das stärkste chemische Reduktionsmittel ist das schwere Alkalimetall
Cäsium (EN 0,70). Es kann andere Metalle aus deren
Bindung befreien, z. B. Titan aus Titanchlorid:
Wie befreit man Cs aus seinem kationischen edelgasartigen Bindungszustand Cs+? |
Das Stichwort lautet Schmelzflusselektrolyse von Cäsiumfluorid CsF (-> Abb. 31). Das stärkste Oxidationsmittel der Chemie ist der anodische Strom, das stärkste Reduktionsmittel der kathodische Strom. Am Pluspol (Anode) und am Minuspol (Kathode) laufen verschiedene Prozesse ab:
Oxidation an der Anode: 2 F¯ ————>
F2 + 2 e¯
Reduktion an der Kathode: 2 Cs+ + 2 e¯ ————> 2 Cs
Man muss dabei verhindern, dass die Elemente sich wieder verbinden, muss also die Räume voneinander trennen. Dies geschieht im Allgemeinen durch ein Diaphragma:
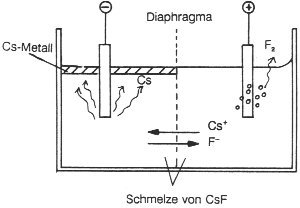
Abb. 31: Elektrolyse von CsF
Schaltet man nach kurzem Elektrolysieren die Pole kurz oder verbindet man sie über einen Verbraucher, läuft unter Umkehrung
der erzwungenen Redoxreaktion der spontane Redoxprozess wie bei einem galvanischen Element ab:

Das Vorzeichen der Pole ändert sich dabei nicht, wohl aber die Bezeichnungen von Anode und Kathode.
Elektrolyse und galvanische Elemente sind somit zwei Seiten einer Medaille (-> Abb. 32 a). Bei der Elektrolyse erzwingt man ein Potential, das beim Betrieb als galvanische Zelle wieder abgebaut wird. Dies verdeutlicht die Abb. 32 für den Bleiakkumulator:

Abb. 32: Schematisches Redoxpotentialsystem des Bleiakkumulators
Galvanische Zellen und Elektrolysesysteme sind von großer technischer und ökologischer Bedeutung.

Abb. 32a: Elektrolyse und galvanisches Element als umkehrbares System