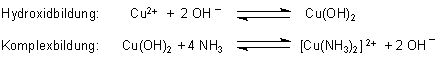
15 Chemische Komplexverbindungen
Komplexverbindungen entstehen durch Reaktion zwischen einem Zentralteilchen (im Allgemeinen ein Metall-Ion) und Liganden (Anionen oder ungeladene Moleküle). Die Bindung kann ionisch bis stark kovalent sein.
Die Verbindungsklasse der Komplexe ist von großer Bedeutung für die Umwelt. Komplexbildung ist eine Ursache dafür, dass sich in einigen Fällen schwerlösliche Verbindungen von Schwermetallen im Überschuss des Fällungsreagenzes wieder auflösen. Dies spielt beim Abtrennen von Schwermetallsalzen aus Abwässern eine wichtige Rolle. Diskutiert wird auch die Mobilisierung von Schwermetall-Ionen bei Gegenwart von komplexierenden Wasserenthärtern wie EDTA oder NTA (-> S. 124). Ein Beispiel:
PbS+ EDTA2¯ ————> [Pb(EDTA)] + S2¯
Übergießt man beispielsweise eine Kupfersalzlösung mit Natronlauge, so beobachtet man nur die Bildung von schwerlöslichem Kupferhydroxid. (Ein ähnliches Beispiel ist das Aluminium-Ionen/Wasser-System (-> 14.7.2).) Der Hydroxidniederschlag löst sich im Falle des Kupfers in überschüssiger Natronlauge nicht mehr auf. Nimmt man statt der NaOH von vornherein eine Ammoniaklösung, so beobachtet man bei überschüssiger Zugabe die Auflösung des Hydroxids unter Bildung eines tiefblauen Komplexes. Folgende Reaktionen laufen ab:
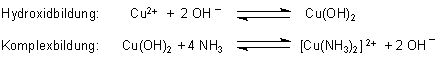
Die Anzahl der Liganden übersteigt in der Regel die Oxidationszahl des Zentral-Ions. Komplexe sind deshalb Verbindungen höherer Ordnung. Ein bekanntes Beispiel ist das Kupfersulfat, das im Kristall fünf Moleküle Wasser gebunden enthält. Es hat die chemische Summenformel CuS04 · 5 H20 (lies: mit fünf H20), die aber chemisch nicht exakt ist. Die richtige Schreibweise ist die eines Aquakomplexes, nämlich [Cu(H20)4]S04 · H20. Vier Wassermoleküle sind als Liganden kovalent an das Cu2+-Ion (Zentralatom) gebunden, das fünfte an das Sulfat-Ion.
Weitere Beispiele sind:
| - | Neßlers Reagenz K2[HgI4]
Ökologisch bedenkliches Reagenz zum Ammoniaknachweis. |
| - | Nickeltetracarbonyl [Ni(C0)4]
Giftiges Gas zur Reindarstellung von Nickelmetall. |
| - | Natriumdicyanoaurat(I) Na[Au(CN)2]
Entsteht bei der Goldoxidation nach dem Verfahren der Cyanidlaugerei und spielt zusammen mit ähnlich gebauten Komplexen anderer Metalle bei der Galvanik eine Rolle (Härtungsmittel). |
| - | Natriumdithiosulfatoargentat Na3
[Ag(S203)2]
Entsteht beim Fixieren von Fotos nach der Entwicklung. Früher Hauptquelle für Recycling-Silber aus Entwicklungsanlagen. |
| - | Rotes Blutlaugensalz
K3[Fe(CN)6]
Bleichmittel in der Farbfotoindustrie, da es das schwarze Silberbild oxidativ auflöst. Heute Hauptquelle für Recycling-Silber. |
| - | Moderne Katalysatoren-Technik beruht weitgehend auf Komplexbildung und Einsatz von Komplexen, z. B. isotaktische Kunststoffsynthesen, Ölentschwefelung. |
Für die Umwelt wichtig sind auch die Aquakomplexe von Aluminium und Eisen(III). Es gibt z. B. das Aluminiumchloridhexahydrat AlCl3 · 6 H20. Die genaue Struktur ist die eines Aquakomplexes:
[Al(H20)6]Cl3
Diese Komplexe bilden sich, wenn durch sauren Regen z. B. Aluminium-Ionen aus Tonmineralien ausgewaschen werden. Sie sind primär so genannte aprotische oder Kationensäuren (-> 14.7.2), da die hochgeladenen Zentral-Ionen die H-O-Bindungen lockern und die Ablösung von Protonen erleichtern.
Andere Liganden haben mehrere Bindestellen für das Zentralatom. Diese Komplexe nennt man Chelate, die Liganden Chelatbildner. Ein Beispiel ist das EDTA (Ethylendiamintetraessigsäure bzw. deren Natriumsalz) mit 6 Bindungsstellen. Vor allem zweiwertige Zentral-Ionen (z. B. Mg2+, Ca2+, Cu2+ oder Pb2+) werden in einer stabilen, oktaedrischen Anordnung umhüllt (-> Abb. 35).
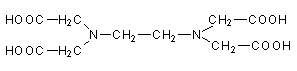
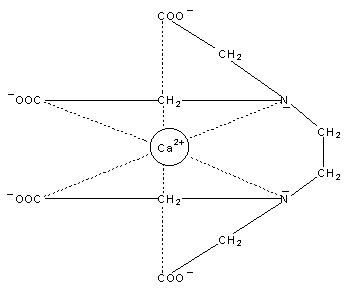
Abb. 35: EDTA, EDTA-Komplex
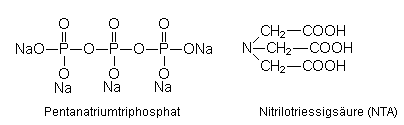
EDTA und das ähnlich gebaute NTA dienten in Waschmitteln als
alternative Wasserenthärter, da
sie wie die cyclischen oder längerkettigen
Polyphosphate Ca- sowie Mg-Komplexe bilden, ohne
eutrophierend zu wirken.
Chelate spielen auch in der Natur eine große Rolle. Wichtig sind biochemische Komplexe wie Chlorophyll (Mg2+), Hämoglobin Hb (Fe2+), Katalase (Fe2+), ADH (Zn2+), Carboanhydrase (Zn2+), Cytochrome (Fe2+) oder Vitamin B12 (Co3+). Huminsäuren sind gegenüber Schwermetallen sehr gute Chelatbildner. Die Giftwirkung von vielen Schwermetallen (Cd, Hg, Cu, Zn) beruht auf der Komplexbildung mit Biomolekülen wie Aminosäuren oder Proteinen. Ähnliches gilt für giftige Liganden wie Cyanid-Ionen CN, H2S oder Kohlenmonoxid CO, die sich an Komplexe wie Hämoglobin oder Cytochrome anlagern und andere Liganden wie Sauerstoff verdrängen.
Der Austausch von Cu2+ gegen Mg2+ im Chlorophyll (-> Chlorophyllin) ist offenbar ein Grund für die Giftigkeit dieses Schwermetalls für manche Pflanzen.
Hieraus ersieht man, dass auch die Komplexbildung durch chemische Gleichgewichte beschrieben werden kann. Dabei kann ein stärkerer Komplexbildner einen schwächeren verdrängen. Beispiel ist CO, das an Hb-Fe2+ 325 Mal stärker gebunden wird als Sauerstoff. Damit verdrängt es dieses aus dem Gleichgewicht. Mit CO vergiftete Personen legt man deshalb in ein Sauerstoffzelt. Dies ist eine praktische Anwendung des Prinzips von Le Chatelier (-> 11.1).