17 Absorption von Strahlung. Spektren
Materie tritt wegen ihrer elektrischen Eigenschaften mit elektromagnetischer Strahlung in Wechselwirkung und absorbiert Teile davon. Dies geschieht nach bestimmten Regeln, die so exakt sind, dass man die Kenndaten der Absorption zur Identifizierung vieler Stoffe heranziehen kann (-> z. B. Abb. 41). Diese Prozesse sind aber auch von großer Bedeutung in der Atmosphärenchemie, die ohne die Beteiligung von kürzer- oder längerwelliger Strahlung nicht denkbar ist.

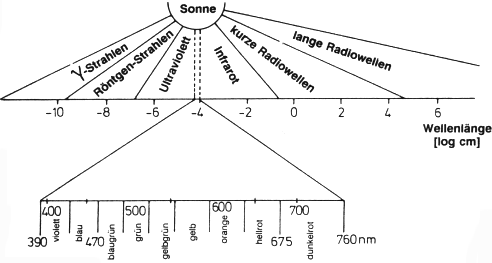
Abb. 37: Spektrum der elektromagnetischen Wellen
Die elektromagnetische Strahlung reicht von der extrem kurzwelligen Gammastrahlung
bis zur langwelligen Radiostrahlung. Man charakterisiert die Bereiche durch die Angabe
der Wellenlängen oder der Frequenz (-> Abb. 37).
Von größtem Interesse für den Chemiker sind die Bereiche Ultraviolett (UV, 200-370 nm), sichtbares Licht (VIS, 370-800 nm) und Infrarot (IR, -> 800 nm). Diese Strahlung, die vor allem auch von der Sonne abgestrahlt wird, absorbieren die Moleküle aufgrund ihrer Valenzelektronen und weniger stark gebundenen Elektronen in großen Doppelbindungssystemen. Dabei werden nur bestimmte Energiepakete aufgenommen, die so genannten Quanten:
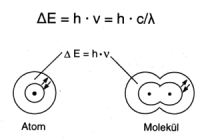
| h : | Plancksches Wirkungsquantum [erg · sec] |
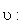 |
Frequenz [sec¯1] |
| c : | Lichtgeschwindigkeit [cm/sec] |
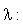 |
Wellenlänge [cm] |
Man kann die Anregung von elektromagnetischen Schwingungen in einem Molekül mit akustischen Modellen vergleichen. Kurze Moleküle entsprechen kurzen, straffen Saiten, große Moleküle langen, weichen Saiten (-> Abb. 38). So absorbiert Butadien im Bereich der kurzwelligen UV-Strahlung, Lycopin (der rote Farbstoff der Tomate) dagegen im längerwelligen VIS-Bereich.
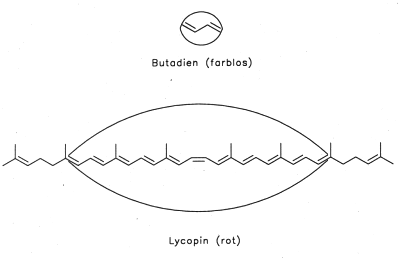
Abb. 38: Akustisches Modell zur Strahlungsabsorption
Durch UV-Strahlung werden die Elektronen von Einfachbindungen und
Doppelbindungen sowie kleine aromatische Systeme angeregt (->
Abb. 40). Die Anregung kann bei höherer Energie so stark sein, dass
die Moleküle auseinanderfallen und Atome bzw. Radikale bilden.
Dies ist besonders der Fall in der oberen Atmosphäre und betrifft
z. B. den Sauerstoff, das Ozon oder die FCKW. Vor allem sind
angeregte Moleküle aufgrund der Lockerung ihrer Valenzelektronen
auch eher bereit, mit anderen Molekülen zu reagieren.
Farben bleichen deshalb unter Bestrahlung, weil die Oxidation
durch Sauerstoff erleichtert wird. Dies ist ein Grund für die teilweise
ungewöhnlichen Reaktionsabläufe in der oberen Atmosphäre.
Zeichnet man den Umfang der Absorption oder die Emission gegen die Wellenlänge auf, erhält man ein Spektrum (-> Abb. 39).
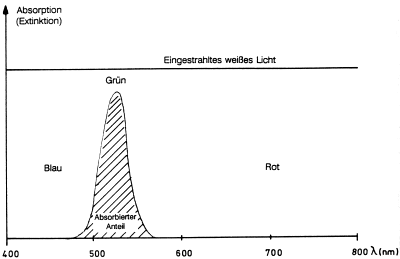
Absorptionsspektrum von purpurfarbener Kaliumpermanganatlösung.
Der Farbstoff absorbiert aus dem weißen Licht den grünen Anteil und lässt Blau und Rot passieren,
die zusammen den Farbeindruck Purpur ergeben
Längerwellige Strahlung, d. h. nahes UV und sichtbares Licht regen
die Elektronen von mesomeren Doppelbindungen an, deren
Doppelbindungselektronen über einen großen Bereich verteilt
sind (-> Abb. 38). Typisch ist dies für Farbstoffe wie dem
Kongorot (-> 16.2), die aus dem eingestrahlten Weiß den sie
anregenden spektralen Teil herausnehmen (absorbieren). Der Rest,
die Komplementärfarbe zum absorbierten Licht, wird abgestrahlt
oder durchgelassen.
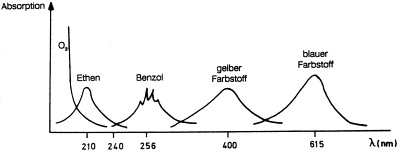
Abb. 40: UV- und VIS-Absorptionsspektren von einigen Substanzen (schematisch)
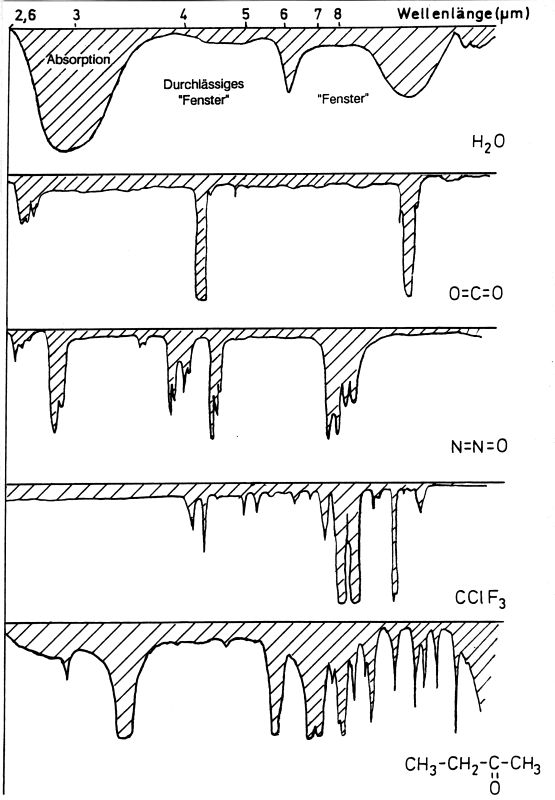
Abb. 41: IR-Spektren wichtiger Treibhausgase.
Man sieht, dass CO2, N2O, FCKW und Methylethylketon (ein typisches Lösemittel)
die "Fenster", die der Wasserdampf offen lässt und durch die IR-Strahlung die Atmosphäre passieren kann, schließen.
IR regt die Schwingungen von Molekülen an und wird als solche im
Molekül gespeichert (-> Abb. 41). Dies ist ein Grund für den
Treibhauseffekt.
Was geschieht mit der absorbierten Strahlungsenergie?
Die Anhebung der Elektronen auf ein höheres Energie-Niveau (Schale, Orbital) kann bis zur Ionisierung von Atomen und Molekülen gehen oder die Auflösung der Bindung zur Folge haben. Ein Teil der eingestrahlten Energie wird stets zur Anregung von Molekülschwingungen innerhalb des Moleküls verwendet. Das kann bei besonders schwingungsfähigen Molekülen auch vollständig geschehen. Eine mit Licht bestrahlte (meistens dunkle) Probe wird sich nur erwärmen.
Fluoreszenzlicht wird in allen Richtungen abgestrahlt und kann bei geeigneten Molekülen erneut absorbiert werden. Danach erfolgt wiederum Fluoreszenz usw., so dass sich die hochenergetische Strahlung langsam und sicher in Richtung auf IR, also letztlich Wärmestrahlung, hin entwickelt.
Fluoreszenz beobachtet man also auch beim IR. Dies ist der Grund für die mehr oder weniger gleichförmige Ausbreitung der Wärme in den bestimmten Bereichen der geschichteten Atmosphäre und somit eine der physikalischen Grundlagen des Treibhauseffektes.