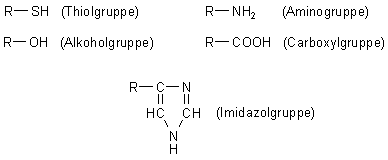Schwermetalle belasten Boden, Wasser und Luft und reichern
sich in Umwelt und Lebewesen immer mehr an. Der Grund
hierfür ist, dass Schwermetalle keinem Abbau unterliegen und
im Allgemeinen im Boden und im Organismus recht fest
gebunden sind, also hoch persistent sind. Da sie
primär aus festen Ablagerungen, also aus der Bodenzone in
die anderen Medien gelangen, sollen sie hier besprochen
werden.
Trotz der Bedenken kann man auf Schwermetalle noch nicht
verzichten. Sie spielen insbesondere bei den folgenden
technischen Anwendungen eine wichtige Rolle:
| - |
Elektrotechnik
Herstellung von elektrischen Leitern, Trockenbatterien und
Akkumulatoren. Hier sind besonders Blei, Quecksilber, Cadmium und Nickel, aber auch die weniger
giftigen Metalle Zink und Mangan zu nennen. |
| - |
Korrosionsschutz
Feuerverzinken, galvanische Überzüge (Cadmieren,
Verzinken, Verkupfern, Verchromen), Rostschutzfarben wie Mennigesuspension. |
| - |
Lampenfüllstoffe
Phosphoreszenzpigmente in Leuchtstoffröhren (z. B. Zinksulfid, in alten Lampen auch noch Cadmiumverbindungen),
UV-Lampen mit Quecksilberdampffüllung. Als ganz besonders nachteilig werden sich langfristig die so genannten
Energiesparlampen erweisen. Obwohl man sie im Volksmund als „Öko-Lampen“ bezeichnet, sind sie alles
andere als ökologisch nachhaltig, denn es ist dem Verbraucher kaum zu vermitteln, dass er lange Wege zu einem „Wertstoffhof“
zurücklegen und dann noch anstehen soll, um defekte Lampen vorschriftsmäßig zu entsorgen. Folglich landen diese Lampen
zum größten Teil einfach im Müll.

Handwerker haben eine Ökolampe in unseren Hausmüll entsorgt
(Foto: Blume) |
|
| - |
Pigmentfarben
Schwerlösliche farbige Verbindungen, vermischt mit Leinöl
oder anderen Dispersionsmitteln. |
| - |
Bestandteile von Legierungen
Quecksilber in Amalgamen, Blei in niedrigschmelzenden
Legierungen, Cadmium in Loten, Kupfer in Messing (u. v. a. m.). |
| - |
Siccative
Cobalt-Naphthenat in Linoleum. |
| - |
Stabilisatoren von Kunststoffen
Cadmium- und Blei-Salze |
1.1 Giftwirkung von Schwermetallen
Bis auf wenige Ausnahmen sind alle Schwermetalle bzw. ihre
Verbindungen mehr oder weniger umweltschädigend. Dies gilt
auch für scheinbar so harmlose Metalle wie Cobalt und Nickel,
deren Salze und Oxide allergen und vielleicht sogar
cancerogen sind. Chrom(VI)-Verbindungen, die Chromate, sind
cancerogen. Aber auch Chrom(III)-Verbindungen können bei
längerer Einwirkung Allergien auslösen. Eisen(III)-Ionen sind
aprotische Säuren.
Die Angriffspunkte im Stoffwechsel sind hauptsächlich Enzyme
und Membranproteine. Deren katalytische Wirksamkeit hängt
besonders von den in Abb. 1 dargestellten funktionellen
Gruppen ab. So ist die Imidazolgruppe, Rest der Aminosäure
Histidin, am Aufbau der aktiven Zentren von
Lipasen und Proteasen beteiligt.
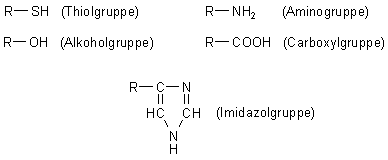
Abb. 1: Funktionelle Gruppen in aktiven Zentren von Enzymen
Typisch für die giftigen Schwermetall-Ionen ist, dass sie gerade
mit diesen Gruppen sehr stabile Verbindungen, Sulfide
und Komplexe bilden können. Damit wird die Bedeutung von
Schwermetallen, die aus Mülldeponien in die oberen
Bodenschichten gelangen, bei der Bodenzerstörung deutlich.
Da Protein-Schwermetallverbindungen sehr stabil sind, häufen
sich Schwermetalle im Körper zunehmend an. Sie sind deshalb
hochpersistente Summationsgifte, die vorrangig Nieren und
Leber sowie die Nervensysteme schädigen.
Die meisten Lebensformen haben im Verlauf der Evolution
gelernt, begrenzte Mengen von Schwermetallen zu tolerieren.
So sind manche in größeren Konzentrationen giftige
Schwermetalle aufgrund ihrer katalytischen Fähigkeiten sogar
zu unentbehrlichen Spurenelementen geworden. Bei Kupfer-,
Zink-, Mangan-, Cobalt- oder Molybdänmangel kommt es sogar zu
schwersten Stoffwechselstörungen.
Eisen ist sogar ein Schwermetall von hoher biologischer
Bedeutung, da es ohne toxisch zu wirken in hohen
Konzentrationen vorliegen und zugleich viele Katalyse- und
Transportfunktionen übernehmen kann. Herausragend ist seine
Mitwirkung bei biologischen Redoxreaktionen (Atmungskette).
In letzter Zeit wird allerdings die mögliche Toxizität von
Eisen-Ionen diskutiert. So sind Fe3+-Ionen starke Radikalbildner,
Oxidationsmittel und Protonensäuren. Dies ist in neutralem
Wasser kein Problem, da hier Eisen-Ionen in schwerlöslichen
Verbindungen (Hydroxide) vorliegen. Mit zunehmender Versauerung der
Gewässer wird auch dieses Metall als Ion mobilisiert. Lies hierzu die
Webseite Wasser und Sauerstoff bestimmen
das Wohlbefinden (Redoxpotential) unserer Umgebung.
Edlere Schwermetalle wie Silber, Gold oder Platin sind nicht
giftig. Der Grund ist folgender: Primär sind nicht die
Schwermetallatome giftig, sondern nur deren Ionen. Ionen von
Edelmetallen haben eine so hohe Tendenz, Elektronen
aufzunehmen, da sie in lebenden Organismen sofort zu
unwirksamen Metallatomen reduziert werden und die zur
Giftwirkung notwendige Ionenkonzentration gar nicht erreicht
wird. In hohen Konzentrationen ist allerdings auch Silbernitrat
giftig. So wurde es früher in der Medizin als Mittel zur
Desinfektion der Augen von Neugeborenen eingesetzt
(Syphilisprophylaxe). Wegen seiner ätzenden Wirkung nannte
man es Höllenstein.
1.2 Recycling von Schwermetallen
Das Recycling von Schwermetallabfällen wird häufig immer
noch nicht als lohnend angesehen. Hierzu tragen in den
meisten Fällen relativ geringe Rohstoff- bzw.
Herstellungskosten bei (Ausnahme: Cadmium).
Außerdem ist die Masse der eingesetzten Schwermetalle im
Vergleich zur Masse des Werkstücks im Allgemeinen sehr
gering, da diese häufig nur als Überzüge oder als
Legierungsbestandteile dienen. Ähnliches gilt für Batterien oder
quecksilberhaltige Thermometer: Hier hat es der Verbraucher
von vornherein mit scheinbar handlichen Wegwerfpackungen zu tun.
Damit gelangen die Schwermetalle nach Gebrauch meistens in Toiletten,
Müllverbrennungsanlagen oder auf Mülldeponien. Spuren
gelangen aber auch in Abwässer.
Für Altakkumulatoren ist eine ausgefeilte Recyclingtechnologie
entwickelt worden.
1.3 Müllverbrennung und Schwermetalle
Bei der Müllverbrennung herrschen aufgrund des hohen Anteils
an organischem Material und wegen des Sauerstoffmangels
Bedingungen, unter denen viele Schwermetallverbindungen
reduziert werden. Bedingt durch den niedrigen Siedepunkt
besonders der giftigsten Schwermetalle und die Flüchtigkeit
von Cadmiumoxid sind die Rauchgase der
Müllverbrennungsanlagen extrem belastet und müssen durch
aufwendige Filteranlagen gereinigt werden. Die dabei
erhaltenen Flugaschen und Filterstäube werden (soweit sie
nicht zur Schwermetallrückgewinnung dienen) auf
Sondermülldeponien gebracht.
Dagegen können die verschlackten Verbrennungsrückstände
als Straßenbaumaterial eingesetzt werden. Der Grund hierfür
ist, dass sie frei von flüchtigen Schwermetallen sind und die
anderen Metalle (wie Blei) in äußerst resistenten, glasartigen
Verbindungen vorliegen.
1.4 Mülldeponien und Schwermetalle
Mülldeponien belasten besonders Böden, angrenzende Oberflächengewässer und das Grundwasser.
Aus Batterie-, Akku-, Farb- und Kunststoffabfällen werden große Mengen an
konzentrierten Schwermetallsalzlösungen freigesetzt, die eine
Ursache der Grundwasservergiftungen sind. Normalerweise
reicht die Bindefähigkeit des Bodens bei niedriger
Schwermetallkonzentration aus, um wie ein Ionenaustauscher
das Grundwasser zu schützen. Bei zu hoher Belastung ist die
Austauschkapazität des Bodens rasch erschöpft, und
Schwermetall-Ionen gelangen ins Grundwasser. Gleiches gilt
bei Kontakt mit saurem Regenwasser, bei dem Protonen die
Schwermetall-Ionen verdrängen.
Problematisch ist die bakterielle Bildung von Methylquecksilber,
einem nervenschädigenden Gas: Hg(CH3)2.
1.5 Ufersedimente und Schlämme. Wurzelraumentsorgung
Die Tendenz zur Mercaptid- sowie zur Komplexbildung ist auch
Grundlage für die Anreicherung von Schwermetallen in
Komposten, Klärschlämmen, Fluss- sowie Ufersedimenten und
H2S-haltigen Faulschlämmen. Vor allem mit Huminsäuren
werden stabile Komplexe gebildet. Da hiervon auch
Spurenelemente wie Cu, Zn, Mo, Co, Fe und Mn betroffen
werden, beobachtet man entsprechende Mangelerscheinungen bei Pflanzen und Tieren besonders häufig in
moorigen Gebieten.
Wurzelraumentsorgung
In diesem Zusammenhang ist das Prinzip der Wurzelraumentsorgung
zu erwähnen. Bei diesem Verfahren leitet man die Abwässer von Gewerbe oder Wohnsiedlungen in ein
Feuchtigkeitsbiotop mit viel Schilf und anderen Uferpflanzen
(wie z. B. in Bielefeld). Die Abwässer enthalten große Mengen
an Stickstoff- und Phosphorverbindungen, so dass das Schilf
ausreichend gedüngt wird. Bakterien, Algen und andere
Mikroorganismen zersetzen in diesem Bereich Fäkalien und
andere organische Abfälle zu Huminsäuren, bauen zusätzlich
eigene Biomasse auf und binden diese Stoffe unter der Bildung
von neuen Sedimenten, welche sich zu Böden verfestigen. Die
Gewässer dürfen nicht so tief sein, da sie "umkippen" können.
Beim bakteriellen Abbau des Wurzelraumsediments (wie auch
von Ufersedimenten, Kompost oder Faulschlämmen) werden
die Schwermetalle allerdings wieder mobilisiert.
Gleiches wird auch für die Phosphatersatzstoffe EDTA und NTA diskutiert,
die als starke Komplexbildner Schwermetalle aus ihren
Sedimenten herauslösen und zu einer Gefahr für das Wasser
machen.
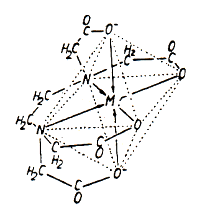
Abb. 2: Räumlicher Aufbau eines EDTA-Komplexes
Heute rückt man von dem Verfahren der Wurzelraumentsorgung
wieder ab, da sich gezeigt hat, dass der anhaltende
Schadstoffeintrag in die Rieselfelder zur Anreicherung in Boden
und Grundwasser sowie zur Belastung benachbarter
Oberflächengewässer führt. Wegen der hohen Bodenbelastung
ist auch eine spätere landwirtschaftliche Nutzung nicht mehr
ohne weiteres möglich.
[Weiterblättern]
Diese Seite ist Teil eines großen Webseitenangebots
mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 15. Juni 2011, Dagmar Wiechoczek