5 Technische Verfahren der Chemie
In den folgenden Abschnitten werden einige exemplarische Industrieverfahren, bei denen Schadstoffe anfallen, behandelt. Dabei wird auch auf die Strategien zur Vermeidung von Umweltschäden eingegangen.
5.1 Historische Prozesse
5.1.1 Herstellung von Alaun aus Schiefer
(Siehe hierzu auch das Kapitel in unserer Kristallwebseite.)
Alaun (alumn) KAl(SO4)2 · 12 H2O wurde früh als Gerbstoff und zur Fixierung von Farbstoffen auf Gewebe und Leder sowie bei der Papierherstellung (-> 6.2.3) benötigt. Bei seiner Herstellung aus dem bitumenhaltigen Alaunschiefer (Lias Epsilon-Schiefer; z. B. in Holzmaden oder in Yorkshire) wurden große Schäden in Landschaft und Natur angerichtet. Die Gewinnung von Alaunschiefer wurde in Deutschland erst um 1890 eingestellt.
In einem englischen Geologiebuch wird die historische Alaunherstellung wie folgt beschrieben:
"Schwarzer Alaunschiefer wird zerkleinert, mit viel Holz in einem Meiler verbrannt, die Reste werden ca. 9 Monate offen belassen. In einem Tank werden die Rückstände mit Urin oder wässrigen Auszügen von verbranntem Seegras vermengt. Man extrahiert dann mit heißem Wasser, siedet und dampft ein."
Hieraus kann man auf die Vorgänge bei der Gewinnung von Alaun schließen.
Alaunschiefer enthält Tonmineralien, also Alumo-Silicate als Verwitterungsrückstände von Feldspäten wie KAlSi3O8 und feinverteilten, deshalb schwarzen Markasit (instabile, verwitterungsfähige Vorstufe von Pyrit FeS2).
Beim Verbrennen werden durch die basischen Aschebestandteile (Pottasche K2CO3) die Silicate aufgeschlossen, Eisen(II) und Sulfid werden zu Eisen(III) und Sulfat oxidiert. Beim Lagern wird die Oxidation vollendet. Die schwach basische Reaktion von Urin oder Seegrasasche führt zur Ausfällung von Eisen(III)-hydroxid. Zum Schluss liegen leicht löslich nur noch Al3+-, K+- und SO42¯-Ionen vor.
Man löst den Alaun mit heißem Wasser heraus und lässt ihn anschließend auskristallisieren.
Umweltschäden betrafen neben den Landschaftsschäden die Emission von SO2 und CO2, Störung der Bodenzone und des Grundwassers bei Langzeitlagerung sowie durch Aluminium-Ionen, basische Schlammdeponien und den großen Holzverbrauch.
Heute wird Alaun durch Behandeln von Aluminiumoxid mit Schwefelsäure und Mischung mit Kaliumsulfat gewonnen.
5.1.2 Sodafabrikation
Soda ist Natriumcarbonat Na2CO3. Diese Verbindung war eine der ersten Grundchemikalien der Menschheit:
| - | Schon die alten Ägypter verwendeten Soda bei der Glasherstellung. |
| - | Bei der Seifensiederei wurde (solange man noch nicht über Natronlauge verfügte) die alkalisch reagierende Soda zur Hydrolyse der Fette eingesetzt. |
| - | Geschätzt wurde Soda auch wegen des schwach alkalischen Milieus ihrer wässrigen Lösungen, weshalb sie auch heute noch als Bestandteil von Waschmitteln Verwendung findet. Gleichzeitig wird durch Carbonat die Wasserhärte herabgesetzt und damit die volle Wirksamkeit der Seifen gewährleistet. |
| - | Später diente Soda zur Gewinnung von Natronlauge:
Na2CO3 + Ca(OH)2 ————> 2 NaOH + CaCO3 Dieses Verfahren ermöglichte die ersten großtechnischen Chemiefasersynthesen (Regeneratcellulose oder Viscoseseide) und damit den Einstieg in die Kunststoffchemie (-> 5.12.2). |
Das Leblanc-Verfahren
Um dem Mangel an Soda abzuhelfen, wurde um 1791 von Leblanc
die erste technische Sodasynthese entwickelt.
Zunächst wurden Kochsalz und Schwefelsäure in Natriumsulfat (Glaubersalz) überführt:
Das Natriumsulfat wird dann mit Kohle reduziert und gleichzeitig mit Kalkstein CaCO3 zu Natriumcarbonat überführt:
Aus dem Schmelzkuchen wurde die Soda herausgelöst. Für 10 t Soda fielen ca. 7 t Calciumsulfid CaS an. Dieses wurde offen deponiert, hydrolysierte dort und setzte den unangenehm riechenden und giftigen Schwefelwasserstoff H2S frei. Außerdem bildete sich dabei ein stark basisches Milieu, welches Böden, Grundwasser und Organismen nachhaltig schädigte.
Als besonders umweltschädigend erwies sich das bei der Herstellung von Glaubersalz entstehende Chlorwasserstoffgas, das mit Wasser Salzsäure bildet. (Die letzte deutsche Sodaanlage nach Leblanc stellte übrigens erst 1923 ihren Betrieb ein!)
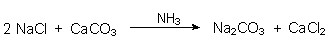
Das Solvay-Verfahren
Sicherlich nicht nur aus Gründen des Umweltschutzes, sondern
auch, weil sich das Leblancsche Verfahren als unwirtschaftlich
erwiesen hatte, wurde 1860 von Solvay eine weniger umweltschädigende
Variante zur Sodaherstellung entwickelt. Die Gesamtreaktion ist formal:

Ammoniak (früher gewonnen aus Kokereiabwässern (-> 5.9.2)) spielt beim Solvay-Verfahren die Rolle eines Katalysators. Es dient ausschließlich zur Aufrechterhaltung eines pH-Milieus, in dem vorrangig Hydrogencarbonationen vorliegen. Diese sind zur Bildung der schwerlöslichen und daher abtrennbaren Sodavorstufe Natriumhydrogencarbonat NaHCO3 notwendig.
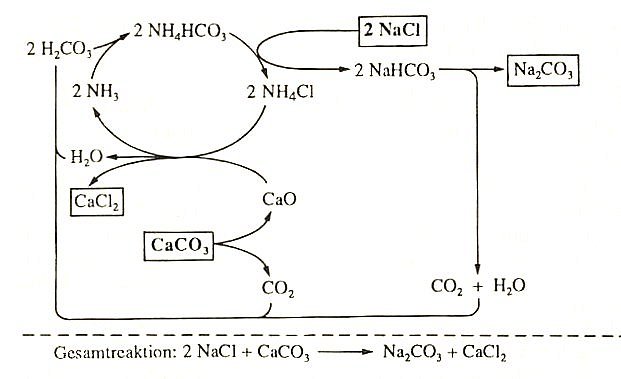
Abb. 7: Reaktionsschema des Solvay-Verfahrens