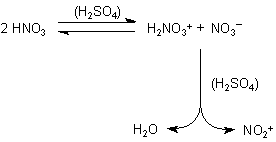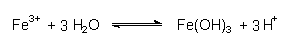Jährlich werden in der BRD mehrere Mio. t Schwefelsäure produziert.
Damit ist diese Verbindung eine der wichtigsten Grundstoffe
der chemischen Industrie.
Verwendung
Beispiele für die Verwendung sind:
| - |
Düngemittelindustrie.
Hier werden 50 % der Schwefelsäure verbraucht.
| - |
Durch Einleiten von Ammoniakgas bildet
sich Ammonsulfat (NH4)2S04. |
| - |
Aufschluss von mineralischen, unlöslichen
Ca-Phosphaten führt zu löslicheren Phosphaten. |
|
| - |
Organische Synthesen.
| - |
Schwefelsäure ist ein Protonenkatalysator
mit hoher H+-Konzentration und zugleich stark wasserentziehender
Wirkung (z. B. bei Veresterungen; -> 5.10.1). |
| - |
Ähnlich wirkt konz. Schwefelsäure auf
Salpetersäure HNO3:
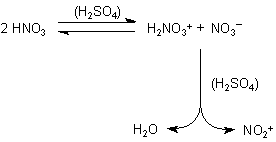
Die Mischung heißt Nitriersäure und dient zur Einführung von
Nitro(NO2)-Gruppen in aromatische und andere Verbindungen.
Mit Toluol bildet sich z. B. Trinitrotoluol (TNT; -> 5.3.4).
Nitroaromaten sind auch Ausgangsstoffe zur Farben- oder
Arzneimittelsynthese. |
| - |
Mit Glycerin bildet sich der Salpetersäureester
Nitroglycerin (-> Dynamit). |
|
| - |
Weitere Beispiele für die Verwendung von
Schwefelsäure:
- Säuerungsmittel.
- Wasserentziehungs/Trocknungsmittel.
- Oxidationsmittel.
- Elektrolyt im Bleiakkumulator (-> 7.3).
- Katalytisch wirkender Elektrolyt bei der Wasserelektrolyse zur
Bildung von Wasserstoff und Sauerstoff.
- Titanataufschluss (-> 5.4.3).
- Auslaugen von Erzen (Leaching, vor allem von Cu-Erzen; -> 5.4.1).
|
Schwefelsäure-Herstellung
Bleikammerverfahren (1736)
Bei diesem veralteten Verfahren wurde Schwefeldioxid SO2 durch
Stickoxide oxidiert. Man erhielt eine mit NOx verunreinigte und
zudem nur maximal 80proz. Schwefelsäure. Dieses Verfahren
erwies sich wegen der Verwendung von Blei und der ständigen
Emission von NOx als sehr umweltschädigend.
Kontakt- und Doppelkontaktverfahren
Dagegen arbeiten die modernen Verfahren umweltschonend und
sind häufig sogar Bestandteil von Entschwefelungsanlagen. Die
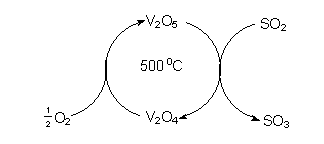
chemische Reaktion ist in Abb. 8 schematisch dargestellt. Man geht
von Schwefel aus oder von sulfidischen Erzen wie Pyrit FeS2, die
man unter Bildung von SO2 verbrennt. Dieses Oxid wird an einem
Kontakt (heterogener Katalysator) zu Schwefeltrioxid SO3 oxidiert.
Letzteres wird in 80proz. Schwefelsäure geleitet. Es bildet sich
rauchende Schwefelsäure (Oleum), die anschließend für die gewünschten
Zwecke verdünnt wird.
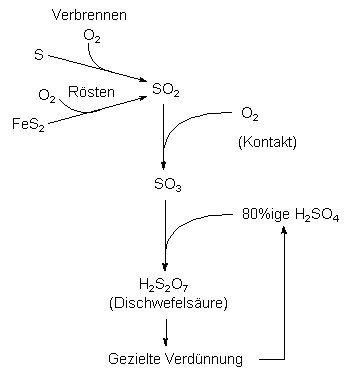
Abb. 8: Schematische Darstellung der Gewinnung von Schwefelsäure
Der Kontakt besteht im Allgemeinen aus Vanadin(V)-oxid V2O5, das
mit Kaliumsulfat K2SO4 dotiert ist. Am Kontakt läuft bei 500 °C
die folgende Reaktion ab:
Das Reaktionsgemisch muss hochgereinigt sein. Vor allem stört
Arsen As, das den Wertigkeitswechsel von Vanadin unterbindet.
(Ähnliche As-empfindliche Kontaktmassen werden auch bei der
Rauchgasentstickung verwendet.) Wegen der hohen Oxidationsenergie müssen
die Kontakte ständig gekühlt werden.
Umweltschädigungen ergeben sich aus der hohen Prozesswärme
und dem nicht quantitativen Umsatz, der zur Emission von SO2 führt.
Heute wird die Prozesswärme einem Energierecycling zugeführt, so
dass die Abfallwärmemengen sehr gering sind.
Die Emission von nicht umgesetztem SO2 verhindert man durch das
Doppelkontaktverfahren, bei dem die Produktgase über einen
zweiten Kontakt geleitet werden.
Dünnsäure
Im Zusammenhang mit der Schwefelsäure fällt häufig das Stichwort
"Dünnsäure". Darunter versteht man eine ca. 25proz. Schwefelsäure,
die bei dem Phosphat- und Titanataufschluss (-> 5.4.3) und
anderen Synthesen (z. B. -> 5.10) anfällt und für technische
Verwendung zu verdünnt und zu unrein geworden ist.
Man könnte meinen, dass - abgesehen von den Verunreinigungen -
die Dünnsäure recycelt werden kann. Dazu ist Aufkonzentrierung
notwendig. Schwefelsäure gibt allerdings nur sehr schwer Wasser
ab. (Deshalb ist sie ja gerade ein exzellentes Trocknungsmittel.)
Hierzu sind sehr hohe Energien notwendig. Erst in neuester Zeit ist
es gelungen, entsprechende wirtschaftliche Verfahren zu entwickeln
(-> 5.10.1).
Die Wirkung der verklappten Dünnsäure ist vielfältig. Einige Punkte
sollen hier angesprochen werden.
Direkte, für Schwefelsäure typische Wirkung:
| - |
Wasserentziehung und Zerstörung organischen
Materials. |
| - |
Beim Verdünnen auch sog. "verdünnter"
Schwefelsäure werden große Wärmemengen frei. Dies senkt den Sauerstoffgehalt
(Demand of oxygen; DO-Wert) der Einleitungs-Region. Kleinlebewesen sind gegen Temperatursteigerungen sehr
empfindlich. |
Saure Wirkung:
Auch nach der Verdünnung verätzt die Säure Kiemen und Schleimhäute
und macht Fische empfindlich gegen Angriffe von Krankheitserregern (Bildung typischer
Geschwüre).
Eisenverbindungen (Grünsalz) in der Dünnsäure:
| - |
Eisen(II) wird zu Eisen(III) oxidiert. Dadurch wird
dem Wasser Sauerstoff entzogen. Im tierischen Gewebe sind aufgrund von
Radikalbildung Schäden durch diesen Prozess möglich. |
| - |
Eisenverbindungen setzen als so genannte Kationensäuren
ebenfalls Protonen frei und wirken zusätzlich versauernd; z. B.:
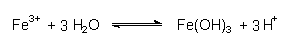
|
| - |
Eisen(III)-Verbindungen sind im sauren Milieu
löslich, bilden im neutralen Kiemenbereich aber flockige Niederschläge. Die Folgen
sind Verstopfung und gleichzeitig Verätzung der Kiemen. |
Andere flockende Verbindungen:
Für Titan- und Aluminiumsalze gilt das Analoge wie für Eisen(III)-Verbindungen.
Sie sind Kationensäuren und bilden flockige Niederschläge.
Schwermetalle:
Diese gelangen besonders beim Aufschluss von Phosphaten in die
Dünnsäure. Man beobachtet allgemeine Vergiftungswirkung auf
Nieren, Leber und Zentralnervensystem. Auch ist Hemmung der
Fortpflanzung möglich.
Senkung des Kohlendioxidgehaltes des Wassers:
Stärkere Säuren wie die Schwefelsäure zersetzen Kohlensäure. Das
Kohlendioxid entweicht. In der Verklappungsregion finden deshalb
kein Algenwachstum und keine Sauerstoffneubildung mehr statt. Die
Folge ist die Störung der Nahrungskette und zusätzlicher
Sauerstoffmangel.