5.7 Kalkstein als Massenchemikalie
Calciumcarbonat oder Kalkstein (Kreide, Marmor) CaCO3 ist eine der wichtigsten Grundchemikalien der chemischen Industrie. Das aus vielen tierischen Schalen und mikrobiologischen Ablagerungen gebildete Sediment Kalkstein war zugleich eine wichtige Senke für Kohlendioxid CO2. Über Milliarden von Jahren wurde durch Lebewesen CO2 ausreichend irreversibel fixiert.
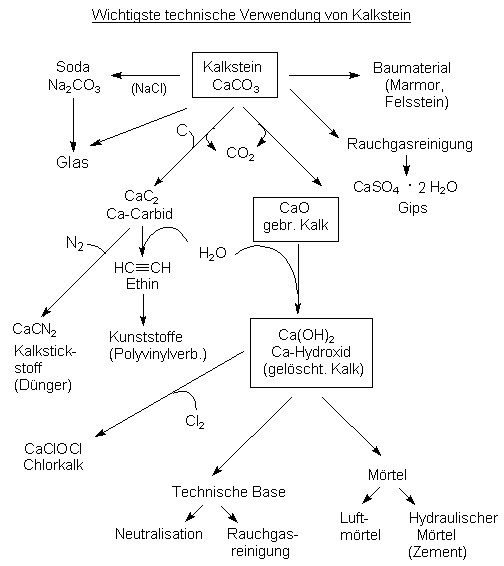
Die Abb. 24 gibt einen Überblick über die wichtigsten chemischen Verwendungen von Kalkstein. Die Übersicht verdeutlicht, wie weitgehend ein relativ einfach aufgebauter Naturstoff durch den Menschen ausgenutzt werden kann. Dabei fällt auf, dass eine große Menge an jeglichen Baumaterialen letztlich auf der Basis von Kalkstein entsteht.

Abb. 24: Wichtigste technische Verwendung von Kalkstein
5.7.1 Chemie des Kalksteins
Kalkstein wird in Steinbrüchen gewonnen, die ganze Landschaften prägen. Beim Erhitzen über 908 °C zersetzt er sich unter Bildung von Calciumoxid CaO, Branntkalk:
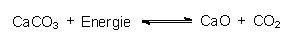
Dazu werden in Drehrohröfen Kalkbrocken im Schrägofen mit einer Öl- oder Gasflamme im Gegenstromverfahren auf ca. 1500 °C erhitzt. Der Kalkstein, der im Allgemeinen noch tonige Bestandteile enthält (Kalkmergel), wandelt sich dabei zu Zementklinkersteinen um, die am unteren Ende des Ofens wieder herausfallen. In Schachtöfen mischt man Kalkstein mit Kohle und presst Luft durch die glühende Mischung. Man füllt kontinuierlich nach, während man am unteren Ende absticht.
Damit der Kalkstein beim Erhitzen nicht allzu großen Aggregaten zusammensintert, müssen die Stücke mindestens faustgroß sein. Die kleineren Stücke dienen als Schottermaterial, Grundstoff für die chemische Industrie, Umwelttechnologie oder einfach nur als Abraum.
Der gebrannte Kalk wird in Kugelmühlen pulverfein gemahlen und wasserdicht gelagert. Im Falle des Zutritts von Feuchtigkeit bildet sich Calciumhydroxid:
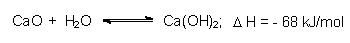
Wegen der hohen Energiefreisetzung spricht man von Kalklöschen, das Produkt ist gelöschter Kalk (Kalkbrei, Kalkmilch). Kalkbrei bzw. Kalkmilch sind die billigsten alkalischen Basen der Technik. Dies gilt auch für Umweltzwecke (Kalksteinverfahren oder Ausstreuen von Branntkalk in von saurem Regen betroffenen Wäldern.)
Reiner Kalkstein wird in großen Mengen auch bei der Glasgewinnung verbraucht. Glas ist eine Verbindung von basischen und sauren Oxiden. Eine typische Glassorte ist z. B. Fensterglas: Na2 · CaO · 6 SiO2 mit der prozentualen Zusammensetzung 13:12:75 (-> 5.8).
Weiter spielt Kalk als Zuschlag bei der Stahlgewinnung im Hochofen (Verschlackungsmittel) oder als Ofenfutter bei der Aufarbeitung von phosphorhaltigen Eisenerzen mit Hilfe der Technologie der Thomasbirne eine wichtige Rolle.
Aus Kalkstein und Braunkohle gewann man in den Carbidöfen (wie z. B. früher in den BUNA-Werken Schkopau) bei 2500 °C Calciumcarbid:
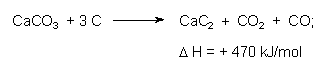
Carbid setzt sich mit Wasser zu Acetylen um:
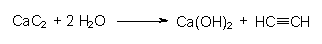
Damit gelingt mit Carbid der Übergang von der anorganischen zur organischen Chemie. An Acetylen lassen sich kleinere Moleküle addieren. Beispiele für diese so genannten Vinylierungsreaktionen sind:
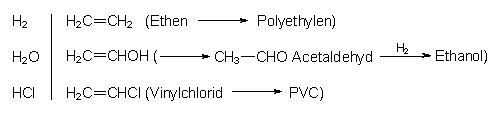
Nachteilig sind bei der Carbidherstellung der hohe Energieverbrauch und die hohe Staubemission. Mit Wasser bilden sich neben Ethin auch Phosphan PH3 und andere giftige Verbindungen, die aus dem Ethin entfernt werden müssen. Heute gewinnt man Ethin auf petrochemischem Wege aus Methan, z. B. durch Pyrolyse im Lichtbogen oder durch unvollständige Verbrennung.
5.7.2 Baustoffindustrie
Der Abb. 24 entnimmt man auch, dass aus Kalkstein viele grundlegende Baumaterialien hergestellt werden.
Die Baustoffindustrie ist einer der wichtigsten Wirtschaftsfaktoren. Beim Hausbau werden eigentlich alle Stoffklassen, die es auf dem chemischen Markt gibt, verbaut. In seiner stofflichen Vielfalt gleicht ein Haus in gewisser Weise dem Auto.
Die mengenmäßig wichtigsten Baumaterialien sind:
Modernes Bauen erfordert die Herstellung künstlicher Steine. Dies ist einfach ein Mengenproblem. Künstliche Steine sind z. B. Kalksandstein, Porenbeton, Klinker, aber auch Betonfundamente und Betondecken. (Da Bauen mit natürlichen Steinen wie Granit problematisch sein kann, zeigt die Diskussion über Radonemissionen.)
Mörtel
Steine werden durch Mörtel zusammengehalten. Mörtel sind
mineralische Bindemittel, die mit Wasser angerührt nach einiger Zeit
steinartig erstarren. Komponenten der Mörtelzusammensetzung
sind:
Bei der Herstellung von Mörtel werden stets gleiche Arbeitsphasen durchlaufen:
Man unterscheidet Luft- und Wassermörtel.
Luftmörtel
Diese Baustoffe härten an der Luft und geben dabei Wasser ab.
Beispiele sind:

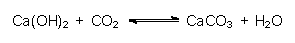
Mit Luftkalk gebaute Wände müssen zur Gleichgewichtsverschiebung intensiv getrocknet werden. Dazu setzt man offene Koksöfen ein, die zugleich CO2 emittieren.
Grundsätzlich wird Zement wie Kalk durch Brennen gewonnen, allerdings sind die Ausgangsmaterialien verschieden. Die Zementgrundmasse besteht aus Kalkmergel.
Kalkmergel ist eine Mischung aus
- Kalkstein CaCO3,
- Tonmineralien, durch Verwitterung aus Feldspat gebildet:
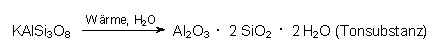
- Eisenoxid und Eisensulfid.
Beim Zementbrennen gibt der Kalkmergel ab 500 °C Wasser ab. Es bilden sich Oxide von Silicium, Aluminium und Eisen, die als Säureanhydride fungieren und mit Calciumoxid CaO zu verschiedenen, sehr stabilen salzartigen Verbindungen reagieren:
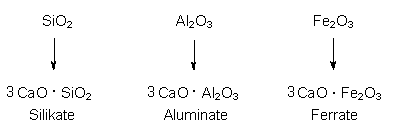
Diese für Zement typischen Tricalciumverbindungen sintern bei 1500 °C. Die abgekühlte Masse wird gemahlen und trocken gelagert.
Zementmörtel
Zur Herstellung von Zementmörtel wird Zementpulver mit Sand
normalerweise im Massenverhältnis 1:3 gemischt. Der Zement
bindet rasch unter Wasseraufnahme ab. Der Härtungsvorgang ist
dagegen sehr kompliziert und dauert dementsprechend lange.
Grundsätzlich bilden sich dabei Hydrate von Calcium- und
Alumo-Silicaten, deren Kristallnadeln verfilzen und die Härte
bedingen. Dazu kommen noch die Prozesse der bereits angesprochenen
Kalkmörtelhärtung (chemische Bindung der Sandkörner
und zugleich Aufnahme von CO2). Wegen der unbedingt notwendigen
Wasseraufnahme härtet Zement sogar unter Wasser aus.
Beton
enthält statt feinem Sand groben Kies. Im Allgemeinen sind im
Beton so genannte Moniereisen eingelassen. Zement haftet auf Eisen
wegen der Fixierung der Silicate über Rost und andere Hydroxide.
Hinzu kommt, dass Eisen und Beton gleiche thermische Ausdehnungskoeffizienten
haben. Allerdings greifen Salzwasser oder
saurer Regen die Moniereisen an, so dass es hier zu ernsten
Korrosionsschäden kommen kann.
Asbestbeton
Asbest ist ein Silicat, das lange Kristallnadeln bildet. Es fördert die
Aushärtungsprozesse der Zementmasse.
Porenbeton
wird hergestellt, indem man zu einer Mischung von gebranntem
Kalk, Zement und etwas Gips Aluminium-Pulver gibt. Aluminium
bildet bei Einwirkung von Basen und Wasser Wasserstoff, der
ähnlich wie CO2 beim Brotbacken das Baumaterial aufbläht:
Das Aluminat wird als Alumo-Silicat eingebaut.
Kalksandstein
Den Vorgang der chemischen Vernetzung von Sandkörnern nutzt
man zur Herstellung von Kalksandsteinen. Hierbei wird der
Bindungs- und Härtungsprozess durch hohe Temperatur und hohen
Druck beschleunigt:
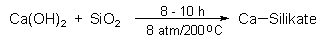
5.7.3 Bauen und Umwelt
Bauen belastet die Umwelt. Gründe hierfür sind u. a.:
Kohlendioxid und Bauen
Beim Kalkbrennen entsteht eine große Menge CO2: einmal durch
den Brennvorgang, das andere Mal durch die Energiebereitstellung
zum Brennen. Als Argument hört man jedoch immer wieder: CO2
wird beim Bauen, speziell beim Abbinden des gebrannten Kalkes
wieder verbraucht.
Dies gilt aber nur für den ersten Teil und dies auch nur dann, wenn der Branntkalk nur zum Bauen verwendet wird. Aber auch dabei wird der größte Teil des Branntkalks CaO mit SiO2, Al2O3, Fe2O3 und nicht mehr mit CO2 umgesetzt.
Schwefeldioxid und Kalkbrennen
Kalkstein enthält geologisch bedingt viele Sulfide (Pyrit oder
Markasit, beide mit der chemischen Zusammensetzung FeS2), die
beim Brennen SO2 emittieren. Durch die Anwesenheit von CaO wird
dieser Schadstoff allerdings (wie beim Kalksteinverfahren zur
Reinigung von Rauchgasen der Heizkraftwerke) abgefangen
und bildet sogar den als Baustoffzuschlag geschätzten gebrannten
Gips. Dieser wird sogar gezielt hergestellt, indem man anstelle von
Kohle oder Erdgas genau berechnete Mengen an schwefelhaltigen
Altreifen beim Kalkbrennen beimischt. Damit kann nicht nur Energie
zugeführt, sondern auch der für bestimmte Zementarten notwendige
Eisengehalt eingestellt werden.
Nachteilig ist, dass viele Altreifen Nylon enthalten und bei der Verbrennung NOx freigesetzt wird.