
Was wir wollen:
Umwelttechnologien - kurz und bündig
"Pädagogen und Politiker reden viel über Umweltprobleme. Doch im Schulalltag kommt
dieses Thema kaum vor." Dieser durch Umfragen gestützte Befund hat seine Ursache vor
allem darin, dass es bislang kaum einfaches und zugleich umfassendes Lehrmaterial für
den experimentell orientierten naturwissenschaftlichen Unterricht mit Bezügen zur
Umwelterziehung gab.
Hier sind die naturwissenschaftlichen Didaktiken gefragt. Unsere Arbeitsgruppe DC2
entwickelt deshalb für den gesamten experimentell zugänglichen Bereich der
Umweltchemie ein Konzept mit vielen Modellexperimenten, das als Grundlage zur
Gestaltung von Unterrichtseinheiten für Chemie und Biologie sowie zur Ausbildung in
Umweltwissenschaften beiträgt.
Umweltchemie ist gar nicht so schwer
Die Umweltchemie gilt als ganz besonders schwer zu vermitteln. Denn ihre Fakten sind
äußerst vielfältig, die oftmals fächerübergreifenden Zusammenhänge von hoher
Komplexität. Anlagen zum Umweltschutz wie die zur Müllverbrennung muten riesig und
unübersichtlich an.

Blick auf eine Müllverbrennungsanlage (MVA Bielefeld)
(Foto: Blume)
Bei genauem Hinsehen jedoch reduzieren sich die Hintergründe auf
relativ einfache Reaktionen. Damit werden Entstehung, Eigenschaften und Wirkung von
Schadstoffen sowie Verfahren zur Minderung von Emissionen anhand anschaulicher
Experimente auch für Schüler demonstrierbar. Das ist vor allem auch für Studierende
wichtig, die Chemie nur als Nebenfach wählen oder an Weiterbildungen teilnehmen.
Anschauliche Experimente sind unerlässlich
Da umwelttechnologische Verfahren in den Schullabors nur in den wesentlichen
Grundzügen nachvollziehbar sind, streben wir an, sie durch neu zu entwickelnde
Versuchsvarianten zu ergänzen oder zu substituieren. Die Experimente müssen an die
oftmals sehr eingeschränkten Möglichkeiten der Schule angepasst werden und in kurzer
Zeit möglichst aussagekräftige Ergebnisse liefern. Dazu arbeiten wir mit überhöhten
Modellen, z. B. mit wesentlich höheren als den "natürlichen" Konzentrationen von
Schadstoffen. Mit präzisen Handlungsanweisungen tragen wir dem mangelnden
Experimentiergeschick Rechnung und schließen Gefährdungen aus.
Das Beispiel Schadgase
Zur Visualisierung von Verfahren der Umwelttechnologie ist besonders die
Emissionsminderung von Schadgasen wie den Stickoxiden, Schwefeldioxid,
Schwefelwasserstoff oder Ozon geeignet. Die im folgenden Text kurz angerissenen
Versuchsvorschriften sind ausführlich auf dieser Webseite und auf der Webseite zum
Ozon dargestellt.
1 Die Entstickungsverfahren
Stickoxide (NOx) entstehen bei allen Verbrennungsprozessen - auch in der Kerzenflamme
weisen wir sie nach. Die chlorartig riechenden, giftigen Gase wirken auch in Spuren
katalytisch bei vielen unerwünschten Reaktionszyklen der Atmosphäre mit und müssen
deshalb aus den Abgasen entfernt werden.
1.1 Wie ein Autoabgas-Katalysator arbeitet
Autoabgase werden mit Hilfe eines Katalysators wie Platin "nachverbrannt". Die
Reaktionsprodukte sind Stickstoff, Wasser und Kohlendioxid. Es reicht zur Demonstration
aber nicht aus, einfach ein Stück eines Katalysatorblocks aus einem Auto zu nehmen.
Denn dessen Keramik adsorbiert das NOx nur und setzt es nicht um.
Wir dagegen stellen hochkonzentrierte Modellmischungen aus rotbraunen Stickoxiden,
Sauerstoff und Methan bzw. Kohlenmonoxid her. Das Platin befindet sich auch nicht
feinverteilt (also unsichtbar) auf einer Keramik, sondern liegt in reiner Form als Drahtnetz
vor. Damit können wir zeigen, dass das Platin an der Umsetzung der
Abgasmodellmischung beteiligt ist, denn der "arbeitende" Katalysator glüht während der
Reaktion hell auf. Das Modell macht außerdem deutlich, dass die Entstickung wie auch in
der Technik nicht vollständig erfolgt. Hiermit werden die Grenzen der Möglichkeiten zur
Emissionsminderung deutlich. Weiterhin demonstrieren wir auch die reversible Adsorption
von NOx an Keramik - allerdings in einem getrennten Versuch.
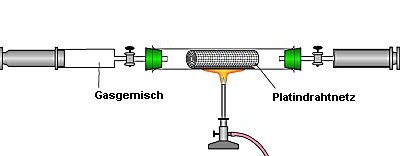
Bild 1: Modell eines Abgaskatalysators
1.2 Modellreaktion zur
Rauchgasentstickung
In den riesigen "DENOX"-Systemen einer MVA oder von Heizkraftwerken wird den
Abgasen Ammoniak zugemischt, das unter Mitwirkung eines Katalysators mit NOx zu
Wasser und Stickstoff reagiert.
Anders als beim technischen Verfahren ist bei unserem Modellexperiment kein besonderer
Katalysator notwendig. Es reicht aus, die beiden hochkonzentrierten Gase in einem
Glaskolben zu vermischen. Augenblicklich bilden sich weiße Nebel von Wasserdampf. Der
Effekt wirkt geradezu alchimistisch.
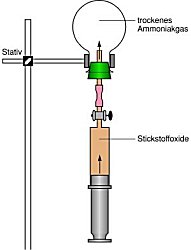

Bilder 2 und 3
Links: Modellversuch zum DENOX-Verfahren;
rechts: Studierende der Umweltwissenschaften
mit dem Modellversuch zum DENOX-Verfahren (Foto: Daggi)
2 Verfahren zur Entschwefelung
Ökologisch bedenkliche Schwefelverbindungen, die in der Schule demonstriert werden
können, sind vor allem Schwefeldioxid und Schwefelwasserstoff.
2.1 Kalksteinverfahren zur Rauchgasentschwefelung
Entschwefelungsanlagen sind mittlerweile bei allen Heizkraftwerken und MVA in einer
Vielzahl von Varianten vorhanden. Bei dem uns interessierenden Verfahren wird
Schwefeldioxid durch wässrig aufgeschlämmten Kalkstein gebunden. Die Mischung
reagiert durch simultane Oxidation mit restlichem Luftsauerstoff zu Gips.
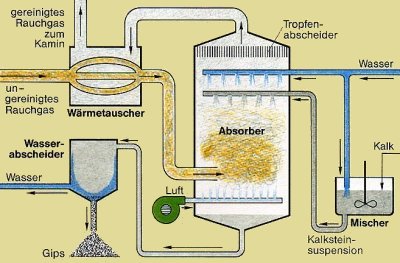
Bild 4: Schema zur industriellen Rauchgasentschwefelung nach dem Kalksteinverfahren
Im Modellversuch zerlegen wir die Reaktion in zwei Schritte, wodurch der Lerneffekt
gesteigert wird. Zuerst lassen wir in destilliertem Wasser aufgeschlämmtes feines
Kalkpulver mit Schwefeldioxid reagieren. Das Schwefeldioxid gewinnen wir durch Erhitzen
von Pyrit, einem stark schwefelhaltigen Eisenerz, das auch in Kohle vorkommt.
Nach einigen Minuten löst sich der Kalkstein auf, die Lösung wird klar. Nun wird zur
Oxidation anstelle von Schwefeldioxid Luft durch die Mischung gezogen. Bald trübt sich
die Lösung wieder aufgrund von nun gebildetem, schwerlöslichen Gips, erkenntlich an
seinen feinen Kristallnadeln.
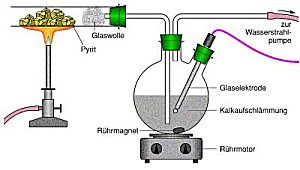 |
 |
Bilder 5 und 6: Modellversuch zum Kalksteinverfahren (Foto: Daggi)
2.2 Vernichtung von Schwefelwasserstoff (Clausprozess)
Dieses nach faulen Eiern stinkende Gas, das aus Erdgas oder als Abfall aus der Erdöl
verarbeitenden Industrie bei der präventiven Treibstoffentschwefelung stammt, wird mit
Schwefeldioxid in Gegenwart eines Katalysators wie Wasser umgesetzt. Auch hier läuft
ein verblüffend einfacher Redoxprozess ab: Die beiden Gase reagieren zu elementarem
Schwefel und Wasser.
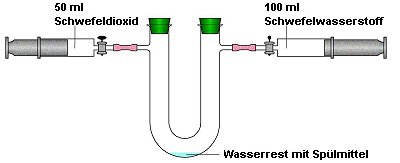
Bild 7: Modellversuch zum Clausprozess
3 Experimente mit Ozon
Die Bedeutung von Ozon ("Oben zuwenig, unten zuviel") muss auch im Unterricht
thematisiert werden. Aber kaum eine Schule verfügt über die teuren Apparaturen zu
dessen Herstellung. Was die meisten jedoch nicht wissen: Das Schadgas mit seinem
"elektrischen Geruch" entsteht als Nebenprodukt bei der Sauerstoffgewinnung durch
Elektrolyse von Schwefelsäure. Seine Konzentration liegt bei 2 Promille, also dem
20.000fachen des atmosphärischen Warnwerts von 0,1 ppm.
Damit können wir alle wichtigen Ozonversuche durchführen. Am beeindruckendsten für
Schüler und Studierende ist die Wirkung auf gespanntes Gummi. Ein aufgeblasener
Luftballon platzt augenblicklich beim Kontakt mit dieser Gasmischung. Ein frischer,
ansonsten unzerreißbarer Gummischlauch zeigt bereits nach ein, zwei Minuten
Ozoneinwirkung lange Risse. Mit dem Anodengas kann man sogar in 1 cm-Küvetten UV-Spektren
des Ozons aufnehmen; die Extinktion beträgt etwa 0,5.

Bild 8: Gummischlauch vor und nach Ozoneinwirkung
(Foto: Daggi)
Umweltchemische Modell-Experimente in den Medien
Die detaillierten Anleitungen zu den vorgestellten Experimenten sind (neben vielen
anderen, wie z. B. zu den nachwachsenden Rohstoffen) über Internet auf unserem
Chemiebildungsserver dc2.uni-bielefeld.de abrufbar.
Diese Webseiten werden nicht nur von Schulen und interessierten Bürgern frequentiert, sondern
zudem in Praktika für Studiengänge zu den Umweltwissenschaften eingesetzt und sogar von Firmen und
anderen Institutionen zur Fortbildung genutzt. Diese Modellversuche haben auch in
modernen Schul- und Lehrbüchern wie z. B. vom Cornelsen-Verlag Eingang gefunden.
Quelle der Graphiken: Schulbücher des Cornelsen-Verlags
Literatur:
R. Blume: Umwelttechnologien kurz und bündig, Forschung an der Universität
Bielefeld, 22/2000.
Weitere Texte zum Thema „Abgas“