 |
| Technische Synthese von Vitamin C |
Die technische Synthese der Ascorbinsäure
Da die natürlichen Ressourcen nicht ausreichen, um den Bedarf an Vitamin C zu decken, synthetisiert man die Ascorbinsäure großtechnisch in Fabriken. Das ist eigentlich ein schwieriges Unterfangen. Denn die gezielte Synthese optisch reiner Formen eines organischen Moleküls bereitet große Schwierigkeiten. Vorteilhaft geht man bei solchen Synthesen von Molekülen aus, die bereits ein ähnliches Gerüst besitzen und als reine Enantiomere leicht zu erhalten sind. Für die Herstellung von Vitamin C bietet sich in Natur und Technik als Ausgangsstoff die D-Glucose an.
 |
| Technische Synthese von Vitamin C |
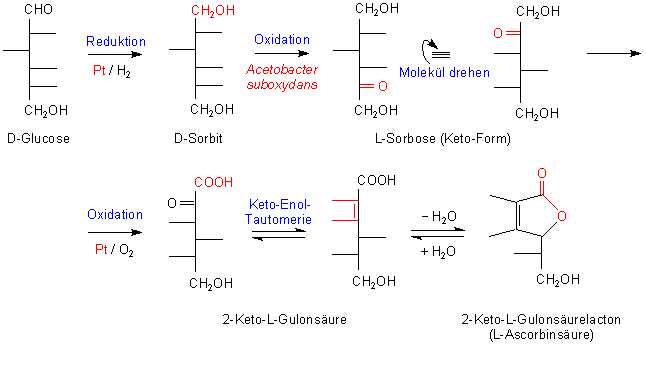
Bei der Synthese von Ascorbinsäure handelt es sich um eine mehrstufige Reaktion, bei der auch der Zusammenhang von Ascorbinsäure und Kohlenhydraten deutlich wird. Bei der Synthese handelt es sich letztlich auch um ein biotechnologisches Verfahren.
Im ersten Reaktionsschritt wird die D-Glucose durch katalytische Hydrierung mit
Wasserstoff zu D-Sorbit reduziert.
In der zweiten Verfahrensstufe wird D-Sorbit zu L-Sorbose oxidiert. Dabei entsteht
eine Ketogruppe am C-Atom 5 der ursprünglich eingesetzten Glucosemoleküle. Damit
besitzt das Oxidationsprodukt bereits die Konfiguration der natürlichen Ascorbinsäure.
Wegen dieser Spezifität nutzt man bei diesem Syntheseschritt Mikroorganismen wie
Acetobacter suboxydans ein, deren Enzyme als stereospezifische Katalysatoren die
Oxidation sterisch richtig und dazu noch quantitativ vollziehen.
Mit diesem Reaktionsschritt ändert sich der Bezugspunkt für die Zuordnung des
Moleküls zur D- oder L-Reihe: Im Sorbose-Molekül gehört das am weitesten von der
Carbonsäuregruppe entfernte asymmetrische Kohlenstoff-Atom zur L-Reihe.
In den weiteren Syntheseschritten findet keine Reaktion mehr statt, bei der eine
Konfiguration verändert wird, so dass diese wieder technisch erfolgen kann.
Es schließt die Oxidation der L-Sorbose zur 2-Keto-L-gulonsäure an. Das geschieht
zum Beispiel am Platinkontakt mit Sauerstoff.
Die 2-Keto-Gruppe lagert sich unter Einbeziehung des Wasserstoffatoms am C-Atom 3 spontan zum 2,3-Endiol um (Keto-Enol-Tautomerie).
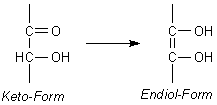
Beim Erwärmen der 2-Keto-L-gulonsäure in verdünnten Säuren bildet sich unter Wasserabspaltung bei gleichzeitigem Ringschluss zwischen den C-Atomen 1 und 4 aus L-gulonsäure ein intramolekularer Ester, das 2,3-Endiol-L-gulonsäure-lacton. Dies ist nichts anderes als die L-Asorbinsäure.
Weitere Texte zum Thema „Ascorbinsäure“