
Der Bleiakkumulator
Experimente:
Versuch: Modellversuch zum Bleiakkumulator
Versuch: Das Silber/Zink-Element
Akkumulatoren sind galvanische Elemente, die sich durch Elektrolyse
wieder aufladen lassen.
Bleiakkumulatoren sind auch heute noch die Ladungsspeicher, die bei hoher Leistungsfähigkeit am wirtschaftlichsten herzustellen sind. Da fast in jedem Kraftfahrzeug ein solcher Akkumulator eingebaut ist und dieser meist nach 3 - 5 Jahren erneuert werden muss, ist der Bedarf an Blei für diesen Verwendungszweck sehr hoch. Derzeit werden 40 - 50 % dieses Metalls für den Akkumulatorenbau verwendet.
Bei der Formulierung der Redoxgleichungen sollte man zur Vereinfachung statt der Hydronium-Ionen nur die Protonen berücksichtigen:
Laden:
Minuspol des Ladegeräts: PbSO4 + 2 H+ + 2 e- ———> Pb + H2SO4
Pluspol des Ladegeräts: PbSO4 + 2 H2O ———> PbO2 + H2SO4 + 2 H+ + 2 e-
Gesamtreaktion: 2 PbSO4 + 2 H2O ———> Pb + PbO2 + 2 H2SO4
Entladen:
Minuspol des Akkus: Pb + H2SO4 ———> PbSO4 + 2 H+ + 2 e-
Pluspol des Akkus: PbO2 + H2SO4 + 2 H+ + 2 e- ———> PbSO4 + 2 H2O
Gesamtreaktion: Pb + PbO2 + 2 H2SO4 ———> 2 PbSO4 + 2 H2O
Bemerkenswert ist, dass sich die Polvorzeichen beim Laden bzw. Entladen nicht umkehren, wohl aber die Richtung der Redoxvorgänge. Damit wechseln nur die Bezeichnungen Anode und Kathode:
Anode ist eine Elektrode mit oxidierenden Vorgängen, Kathode eine Elektrode mit reduzierenden Vorgängen.
Man kann beide Gesamtreaktionen zu einer reversiblen Reaktion zusammenfassen:

In Kurzschreibweise können die Vorgänge unter Verwendung der Oxidationszahlen von Blei wie folgt dargestellt werden:

Im entladenen Zustand ist das System spannungsfrei, da beide Elektroden die gleiche Oxidationszahl aufweisen. Im geladenen Zustand sind die Oxidationszahlen der Elektroden verschieden. Da die Elektronen einen Ausgleich anstreben, resultiert daraus eine elektrische Spannung. Das kann man auch graphisch in einem Potentialdiagramm gut darstellen:
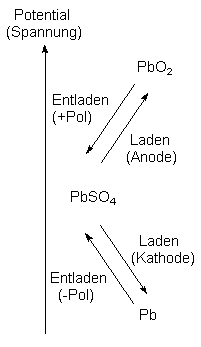
Hierdurch wird deutlich, dass beim Ladevorgang das System aus zwei Halbzellen mit mittleren, arbeitsunfähigem Potential je eine Halbzelle mit hohem und eine mit tiefem Potential aufgeteilt wird. Dadurch bildet sich eine hohe Potentialdifferenz aus, aus der heraus elektrische Arbeit gewonnen werden kann.
Im Versuch zum Modell des Bleiakkus (-> Versuch) geht man von zwei identischen Bleiplatten aus. Diese überziehen sich beim Einbringen in Schwefelsäure spontan mit Bleisulfat. Damit starten wir den Versuch im entladenen Zustand.
Mit diesem Modell lassen sich die Bildung bzw. Rückbildung der Elektrodenüberzüge nicht zeigen. Das gelingt aber sehr gut mit dem Silber/Zink-Element (-> Versuch).
Beim Studium der Gleichungen wird deutlich, dass wir den Ladevorgang auch mit einer Dichtemessung verfolgen können: Beim Entladen entsteht Wasser und die Schwefelsäure wird verdünnt, somit nimmt ihre Dichte ab. Beim Laden nimmt die Konzentration der Schwefelsäure und damit ihre Dichte wieder zu.
Ein Bleiakku kann nur funktionieren, weil Wasserstoff gegenüber dem Metall Blei eine hohe
Überspannung hat. Das bedeutet, dass beim Laden der Vorgang der Reduktion von
Wasserstoff-Ionen an der Elektrodenoberfläche stark gehemmt ist, so dass stattdessen die
Blei-Ionen zu Blei reduziert werden.
Die Überspannung kann man durch Bildung von Lokalelementen herabsetzen. Um diese
herzustellen, gibt man zum Akku Edelmetallsalze zu. Gegenüber Edelmetallen wie z. B. Platin
oder Silber hat Wasserstoff nur eine sehr geringe Überspannung. Deshalb entwickelt der Akku
beim Laden nur noch Wasserstoff (er "gast") und bildet keine Bleiüberzüge mehr. Solche Akkus
lassen sich nicht wieder aufladen.
Wegen der Giftigkeit des Bleis hat man gerade für Altakkus ein ausgefeiltes Recyclingverfahren entwickelt.
Weitere Texte zum Thema „Auto“