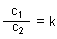
Stoffverteilung zwischen zwei flüssigen Phasen (Extraktion)
Experimente:
Versuch: Extraktion von wässrigen Iodlösungen mit Dichlormethan
Löst man einen Stoff in einem bestimmten Lösemittel und gibt man ein mit diesem
nicht mischbares Lösemittel hinzu, so bilden sich zwei Phasen aus. Wenn der gelöste Stoff
auch in dem zweiten Lösemittel löslich ist, geht ein Teil des in der Phase 1 gelösten
Stoffs in die Phase 2 über. Dazu muss man die beiden Phasen durch
Schütteln innig vermischen. Es findet somit ein ständiger Austausch über die
Phasengrenzen hinweg statt, bis sich ein dynamischer Gleichgewichtszustand
einstellt, das Verteilungsgleichgewicht.
Das Einstellen des Verteilungsgleichgewichtes bei der Stoffverteilung zwischen zwei flüssigen Phasen hat zur Folge, dass das Verhältnis der Konzentration des gelösten Stoffes in der einen zu der in der anderen Phase konstant ist. Dies beschreibt der Nernstsche Verteilungssatz.
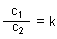
c1 steht für die Konzentration des gelösten Stoffes in der einen und c2
für die Konzentration desselben gelösten Stoffes in der anderen Phase. Die Konstante k ist der
Verteilungskoeffizient. Dieses Verhältnis der Stoffverteilung kann bei dem
Versuch zur Verteilung von Iod zwischen den zwei Phasen Wasser sowie Dichlormethan verdeutlicht
werden
(-> Versuch).
Das zunächst in der Mischphase aus Wasser und Methanol gelöste Iod wechselt über die Phasengrenze in die Petroletherphase über. Nach einiger Zeit bleibt die Farbintensität in den beiden Phasen konstant.
Da sich das Iod besser im Dichlormethan als in Wasser löst, kann es durch mehrmaliges Extrahieren nahezu vollständig aus dem Wasser entfernt werden. Darauf beruht das Prinzip des "Ausschüttelns" eines Stoffs aus seiner Lösung.
Weitere Texte zum Thema „Chromatographie“