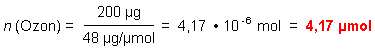
Konzentrationsberechnungen in der Umweltchemie
Viele Konzentrationsangaben der Umweltchemie verwirren wegen ihrer Redundanz den Leser. So werden Massen- und Volumenangaben verwendet, die dazu noch auf unterschiedlichste Einheiten der belasteten Medien normiert werden. Die Verwirrung spiegelt sich auch in Zeitungsberichten zu Umweltfragen wieder. So schreibt beispielsweise der Spiegel (20/1999) über den Schwefelgehalt von Treibstoffen: "... Gleichzeitig sollen die Schwefelgehalt-Grenzwerte für Benzin von derzeit 300 Teilchen pro Million (ppm) und für Diesel von 500 ppm drastisch sinken - auf einheitlich 10 ppm. ..." Dies ist eine weitere Variante von ppm (wenn auch in diesem Fall sicherlich Massenanteile gemeint sind, da es sich nicht um Gase, sondern um Flüssigkeiten handelt).
Ein typisches Beispiel sind die Konzentrationsangaben für Ozon, die man in dem MAK-Wert, den täglichen Ozonmeldungen oder in den von vielen Umweltorganisationen publizierten Ozonkarten findet. (Alle diese Angaben sind für Chemiker sowieso nicht logisch. Für ihn zählen nur Konzentrationsangaben wie Mol/l oder andere Größen, die proportional zur Teilchenzahl des Schadstoffs sind. Siehe hierzu die Webseite "Vom Sinn der Molmassen".)
Problem:
Der MAK-Wert von Ozon wird in verschiedenen Quellen wie folgt angegeben:
0,2 mg (200 µg)/m3 Luft
0,1 ml (100 µl)/m3 Luft
4,17 µmol/m3 Luft
0,1 ppm (100 ppb)
1 Teilchen Ozon auf 10 Mio. Teilchen Luft
Diese Werte sehen doch sehr zufällig aus. Ob sie alle das Gleiche aussagen, wollen wir anhand von Überschlagsrechnungen überprüfen. Wir gehen dabei als Standard von der Masse / m3 Luft aus.
Zuerst berechnen wir die Molzahl n des Ozons in
1 m3 Luft.
Die Molmasse des Ozons ist 48 g/mol.
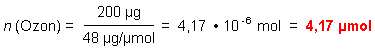
Nun rechnen wir nach, ob deren Volumen tatsächlich 100 µl ist.
1 mol => 22,414 l (Satz von Avogadro)
Bei 20 °C ist das Volumen 10,7 % größer:
1 mol => 24,056 l
1 µmol => 24,056 µl
4,17 µmol Ozon => 100,3 µl » 100 µl
Dann berechnen wir zur Überprüfung des
ppb- bzw. ppm-Wertes die Anteile des Ozons in der Luft. Damit klären wir
zugleich die Frage, worauf diese Werte normiert wurden: auf Masse oder
Volumen der Luft.
1. Massenanteile
1 m3 Luft => 1,29 kg => 1,29 · 109 µg
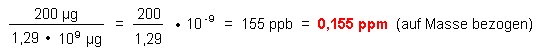
Dieser Wert stimmt nicht mit der Angabe bei den MAK-Werten überein.
2. Volumenanteile
1 m3 Luft = 109 µl
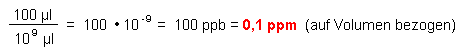
3. Auf Teilchenzahlen bezogene Anteile
| A | Diese ppm-Definition ist im Fall von Gasen identisch mit
der auf Volumen bezogenen Angabe. Dahinter steckt der Satz von Avogadro, dass gleiche
Volumina von verschiedenen Gasen die gleiche Teilchenzahl enthalten. Volumenzahlen sind bei
Gasen deshalb proportional zu Teilchenzahlen. Sie sind sogar unabhängig von Druck und
Temperatur, da diese Korrekturen alle Gase gleichmäßig betreffen (abgesehen von
Realgas-Korrekturen).
Der Teilchenanteil ist also 1 Ozonteilchen auf 10 Mio. Luftteilchen = 0,1 ppm (auf Teilchenzahl bezogen) |
| B | Den auf Teilchenzahl normierten ppm-Wert kann man auch
über die Molzahlen berechnen. Hier folgt die Überschlagsrechnung:
Ein Kubikmeter trockene Luft hat bei Normalbedingungen die Masse 1,29 kg. Die Molzahl der Luft berechnen wir mit Hilfe der durchschnittlichen Luftmolmasse ML. Dabei berücksichtigen wir nur Stickstoff, Sauerstoff und Argon: ML = 0,781 · 28,02 g/mol + 0,21 · 32 g/mol + 0,0093 · 39,95 g/mol = 21,88 + 6,72 + 0,37 = 28,97 g/mol Die Molzahl n der Luft in 1,29 kg ist dann n (Luft) = 1290 g / 28,97 g/mol = 44,53 mol Wir vergleichen die Teilchenzahlen von Ozon und Luft: |
Die verschiedenen Angaben des MAK-Werts sind also in sich stimmig.