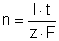
Materieumsatz bei einer Brennstoffzelle
Um zu verdeutlichen, dass bzw. wie viel Wasser bei der Knallgasreaktion in einer Brennstoffzelle entsteht, kann der Materieumsatz berechnet werden. Bei der Bildung von einem Mol Wasser werden zwei Elektronen umgesetzt:
2 H+ + 1/2 O2 + 2 e- —> H2O
Die bei der Reaktion entstehende Wassermenge in Abhängigkeit von der Stromstärke
und der Betriebsdauer berechnet sich wie folgt.
Allgemeine Formel:
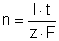
n: Stoffmenge des gebildeten Wassers [mol]
I: Stromstärke [A]
t: Betriebsdauer [s]
z: bei der Reaktion umgesetzte Mol Elektronen (z = 2)
F: Faraday-Konstante 96.480 As/mol
Um das Volumen V (in cm3) der Wassermenge zu erhalten, müssen die
Molmasse des Wassers mit
M = 18 g/mol und die Dichte mit d = 1 g/cm3 berücksichtigt werden.
Das geschieht nach folgender Formel:
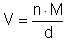
Das folgende Diagramm dient der graphischen Ermittlung der Wassermenge als Funktion der Zeit. Parameter ist die Stromstärke.
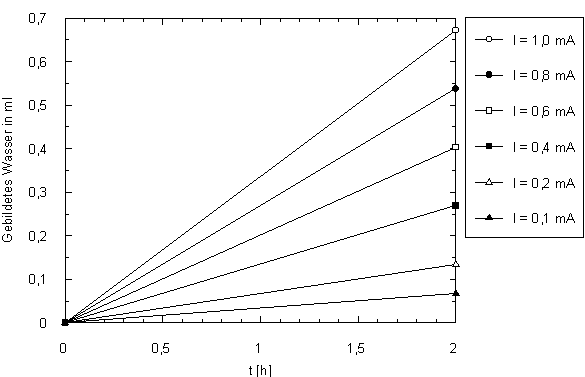
Wenn Stromstärke und Betriebsdauer bekannt sind, kann die entstehende Menge Wasser mit diesem Diagramm graphisch ermittelt werden. Der x-Achsenabschnitt der Betriebsdauer ergibt auf der jeweiligen Steigungsgerade der bestimmten Stromstärke das Volumen des Wassers, das auf der linken y-Achse abgelesen werden kann.
Weitere Texte zum Thema „Brennstoffzellen“