 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
911
F: Könnten sie mir bitte sagen, wie man am Besten eine Kochsalz\Speiseölgemisch
von einander trennen kann?
Und zweitens welches Trennungsverfahren wird angewandt, um die Trockenmasse in Lebensmitteln zu bestimmen?
Vielen Dank im vorraus!
A: Komische Fragen...
1 Lösen Sie mit Wasser das Salz heraus.
2 Zuerst wiegt man die Lebensmittel. Dann trocknet man die Lebensmittel - zum Beispiel durch vorsichtige
Wärmezufuhr (Temperatur um 120 °C) in einem Ofen (kann Stunden dauern!). Dann wiegt man die Lebensmittel erneut.
Die Differenz ergibt den Wassergehalt.
912
F: Im heutigen Chemieunterricht wurde von uns Schülern (Jahrgangsstufe 11) ein
Experiment mit Duftwässern durchgeführt. Dabei sollten drei verschiedene Duftwässer (Eau de Parfum, Eau de
Toilette, Rasierwasser) zunächst mit Wasser gemischt werden. Bei der Beobachtung stellte sich heraus, dass
sich die Lösungen/Mischungen trübten. Gab man zu diesen ein wenig Ethanol, verschwand die Trübung wieder.
In der dazugehörigen Hausaufgabe sollen wir diese Vorgang selbstverständlich in einem Protokoll zusammenfassen
und Auswerten. Da mir kein Grund für die Trübung einfällt und ich nach Recherchen im Internet auf keine Lösung
des Problems gekommen bin, möchte ich Sie darum bitten, mir den Grund für den Sachverhalt zu nennen.
Vielen Dank für ihr Verständnis.
A: Dahinter verbirgt sich eine wichtige chemische Methode zur
Substanzabtrennung aus Gemischen.
Es handelt sich um ein Phänomen, das man als "Mischungslücke" bezeichnet: Eine unpolare Substanz ist zwar
in Ethanol löslich, nicht aber in Wasser. Wenn man nun zu einer derartigen alkoholischen Lösung Wasser gibt,
verändert sich das Lösemittelgemisch und wird immer polarer. Irgendwann kann die gelöste unpolare Substanz nicht
mehr in der Lösung bleiben und es gibt eine Trübung. Das sind lauter kleine Tröpfchen im Ethanol/Wasser-Gemisch.
Die Substanzen können auch ausflocken. Gibt man wieder Ethanol zu, wird das Lösemittelgemisch wieder unpolarer,
und die Trübung verschwindet.
Das gleiche beobachtet ihr, wenn ihr zu Anisschnäpsen wie Raki oder Ouzo (die ihr natürlich nicht kennt!)
Wasser gebt.
Es geht auch umgekehrt: Durch Alkoholzusatz könnte Ihr aus einer wässrigen Salzlösung Salz ausfällen.
Ihr könnt auf diese Weise auch bestimmte Vergällungsstoffe wie den Petrolether aus bestimmten Spiritus-Sorten
entfernen. (Vorsicht! Das geht aber nicht bei allen Vergällungsstoffen!)
913
F: könnten Sie mir eventuell die chemischen Vorgänge beim langsamen
Entfärben an der Luft (wahrscheinlich durch Kohlensäure) von mit Phenolphthaleinlösung angefärbter
Natriumhydrogenkarbonatlösung ("Ökologische Geheimtinte") mit Hilfe der Brönstedschen Säure- und
Basendefinition mitteilen. Irgendwie habe ich da eine Denkblockade. Warum Natriumhydrogenkarbonatlösung
basisch reagiert ist mir klar, aber wie neutralisiert sich das?
A: Ein Teil des Hydrogencarbonats bildet mit Wasser OH--Ionen
(Stichwort "Protolyse").
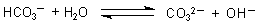
Diese OH--Ionen sind die Ursache für die schwache Rotfärbung der Phenolphthalein-haltigen Lösung.
In der Luft befinden sich Säurebildner wie vor allem CO2. Das reagiert mit Wasser zu Kohlensäure, die die OH--Ionen wegfängt.
914
F: Wir haben ein rätselmärchen gelesen, welches wir nicht lösen können: eine
böse hexe hält dich gefangen, sie hat 2 weisse salze, kaliumiodid (hochgiftig!) und natriumchlorid. Die lösung eines
der beiden salze muss man trinken, man darf die lösung selber herstellen und verwendung von 3 geräten und wasser.
Können sie mir aüf die sprünge helfen? Ich weiss nicht weiter!
A: Die beiden Salze lassen sich mit Hilfe der Flammenprobe über ihre
Kationen sehr einfach unterscheiden (Natrium: leuchtend gelbe Flammenfärbung, Kalium: violett). Als Geräte
empfehle ich daher: Gasflasche, Brenner und Magnesia-Stäbchen.
915
F: Wenn bei einer Umgruppierung von Atomen Energie frei gesetzt oder
verbraucht wird, wie verhält es sich dabei bei den Molekülen? Verändert sich dabei die Temperatur der Moleküle?
Falls ja, wieso?
A: Sie fragen: Wo bleibt die Energie, die bei einer chemischen Reaktion
frei wird?
Zuvor eine Anmerkung: Moleküle haben keine Temperatur. Zwar kann man entsprechend der klassischen Energiegleichung
E = k · T
aufgrund der eine chemische Reaktion begleitenden Energieumwandlungen den Molekülen eine Temperatur T (hier in Kelvin) zuordnen - aber das ist keine mit einem Thermometer messbare Temperatur in unserem Sinn, sondern eher formal zu sehen. (k ist die Boltzmann-Konstante. Das ist quasi die Gaskonstante R für ein Molekül.)
Moleküle strahlen im Verlauf ihrer Umgruppierung allerlei elektromagnetische Strahlung ab oder absorbieren sie -
also pure Energie. Das kann Lichtenergie sein (also Feuer oder Lumineszenz sowie andere Strahlung -
zum Beispiel aus dem UV-Bereich). Dieser Energiebereich betrifft vorrangig die angeregten Elektronen.
Begleitend schwingen in den Molekülen ihre Teile gegeneinander und erfahren dabei eine Veränderung als
oszillierende elektrische Dipole. Die strahlen wie Antennen Infrarot ab.
Dazu kommt noch die durch die Energiezufuhr ausgelöste Rotation der Moleküle - das kann die Emission von
Mikrowellen verursachen.
Hinzu kommt die kinetische Energie, die die Teilchen bei all dem erfahren.
Nach einiger Zeit der Energieabgabe hat sich das System beruhigt. Andernfalls bleibt es instabil und fliegt bald auseinander. Deshalb muss man viele Reaktionsprodukte ziemlich tief kühlen, damit sie erhalten bleiben.