 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1146
F: Ich unterrichte derzeit Enzymatik und habe Versuche mit Harnstoff,
Thioharnstoff und Urease gemacht. Können Sie mir die Reaktionsgleichung für die Hydrolyse von Thioharnstoff nennen?
A: Thioharnstoff ist wie auch Harnstoff recht stabil. Reaktionsbedingungen
sind Wärme sowie alkalische oder saure Lösungen. Es bilden sich Ammoniak/Ammonium, CO2 (etc.) sowie
Schwefelwasserstoff und Sulfide. Formal gilt:
(NH2)2C=S + 2 H2O ———> 2 NH3 + CO2 + H2S
1147
F: Ich bin Referendarin und unterricht das Fach Chemie. Meine
Fachausbilderin für Chemie behauptet, dass man mit dem Fehling-Reagenz sowohl primäre als auch sekundäre
Alkohole nachweisen kann. Stimmt das?
Meiner Meinung nach liegt sie da falsch, da doch sonst auch bei den Zucker die Hydroxygruppen und
nicht nur die Aldehydgruppe oxidiert werden müsste. Ich würde mich sehr freuen, wenn sie mir diesbezüglich
eine Antwort geben würden. Ich hab sowohl in Bücher als auch im Internet nach anderen Funktionellen Gruppen
gesucht, die mit dem Fehling-Reagenz nachgewiesen werden können, wurde aber leider nicht fündig.
A: Nur lebensmüde ReferendarInnen legen sich mit ihren FachleiterInnen
an... Bringen Sie ihr Folgendes deswegen besonders schonend bei:
Die Fehlingsche Mischung reagiert grundsätzlich mit allen stärkeren Reduktionsmitteln wie den Aldehyden und
vor allem mit reduzierenden Zuckern wie z. B. Glucose, Fructose oder Maltose sowie Lactose. Normale p- oder
s-Alkohole reagieren nicht. Probieren Sie es doch einfach mal zusammen mit Ihrer FL´in aus.

Fehlingsche Probe mit Aceton, Glucose (orangerot) und Isopropanol
(Foto: Daggi)
Eine Ausnahme stellt das Glycerin dar. Das reagiert rasch, fast schon in der Kälte, mit der Fehling-Mischung.
Vielleicht hat Ihre Chefin aber Hydroxylverbindungen wie Enole oder Di-enole im Kopf. Di-enole z. B. bilden das aktive Zentrum der Ascorbinsäure, mit der die Fehling-Mischung schon in der Kälte reagiert. Vielleicht denkt sie auch an Mehrfach-Alkohole des Benzols wie Hydrochinon. Auch mit denen geht’s ohne Erwärmung.
Oder die FL meint die durch Cu/CuO katalysierte Oxidation von Alkoholen.
Der Tipp des Monats "März 2006" gefasst sich übrigens mit den Zuckernachweisreaktionen.
1148
F: Warum bleichen die Farben der Badeanzüge besonders aus?
A: Sie sind feucht; es bilden sich beim Sonnenbaden durch Bestrahlung
mit UV Radikale wie HO· oder HO2·. Diese zerstören die
Farbstoffe. Deshalb bleicht auch feuchtes Haar besonders rasch aus.
Hinzu kommt das Chloren von Schwimmbädern. Im Wasser bildet sich Hypochlorit, das Sauerstoffatome freisetzt
und deshalb ähnlich wie die o. a. Radikale wirkt.
HClO ———> HCl + O
1149
F: Ich behandle zur Zeit im Chemieunterricht im Rahmen von Säuren und
Laugen die Citronensäure und habe folgendes Problem: Weshalb reagiert Universalindikatorpapier auf die Schmelze
deutlich sauer, obwohl sie andererseits den elektrischen Strom nicht leitet.
A: Citronensäure liegt kristallin im Allgemeinen als Monohydrat vor.
Beim Schmelzen wird das Kristallwasser freigesetzt, das dann als Base zur Übernahme von Protonen der Citronensäure
dient. Die so gebildeten Hydronium-Ionen H3O+ reagieren mit den Molekülen des Indikators
unter entsprechender Farbänderung.
Zum Erkennen von Veränderungen der elektrischen Leitfähigkeit mit Hilfe der üblichen Stromkreise ist die
Konzentration der Protonen allerdings viel zu gering.
1150
F: Ich bin Lehrerin an einer Berufsschule im NTW Bereich und unterrichte
vor allem die Chemielaboranten. Ich habe eine Unterrichtsstunde zum Thema Diethylether und sein Gefahrenpotenzial
(hinsichtlich Peroxidbildung) konzipiert. Leider fehlt mir bisher immer noch eine Vorschrift zu Zerstörung der
Hydroperoxide mit Eisen(II)salzlösung. Überall liest man zwar, dass dies die gängige Methode ist, aber es ist
nirgendwo ein Beispiel für die praktische Durchführung zu finden. Wie oft muss ausgeschüttelt werden, ist die
vollständige Umsetzung erkennbar, welchen Massenanteil soll die Lösung besitzen, .....das sind alles Fragen,
die ich mir dabei stelle. Leider konnte mir auch Firma Merck keine eindeutige Auskunft dazu geben. Das Perex-Kit
zur Zerstörung der Peroxide wird zudem leider nicht mehr hergestellt.
Dummerweise habe ich während meiner eigenen Chemielaborantenausbildung und auch während meines Studiums
nur den Nachweis der Entstehung der Peroxide mit Iodidlösung durchgeführt, nicht aber die Zerstörung (ich kann
mich zumindest nicht mehr erinnern). Daher wende ich mich jetzt doch recht verzweifelt mit der Frage an Sie,
ob Sie vielleicht eine Vorschrift dazu kennen oder eine andere Idee haben, wie man an eine solche gelangen könnte?
Ich würde sowohl Nachweis als auch Zerstörung gern im Unterricht durchführen (lassen), bin mir aber weiterhin
nicht sicher, ob es sinnvoll ist, einen positiven Peroxidnachweis nun gerade mit Ether durchzuführen. Könnte man
diesen vielleicht durch ein anderes Lösemittel mit weniger Gefährdungspotenzial substituieren und einfach mit verd.
Wasserstoffperoxidlösung anreichern?
A: Geraten Sie bitte nicht in Panik! Vorschriften zum Umgang mit
Chemikalien wie Ether findet man in Lehrbüchern wie zum Beispiel "Organikum" aus dem Johann Ambrosius Barth Verlag.
Das müssten Sie eigentlich kennen und sogar besitzen!
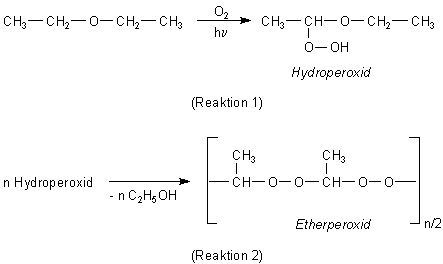
Alle Ether (vor allem auch die cyclischen wie Furan oder Dioxan) bilden Peroxide, wenn sie mit Licht bestrahlt
werden. Die Reaktion ist eine radikalische Kettenreaktion, die durch den Angriff eines Sauerstoffmoleküls
eingeleitet wird.
Zunächst bilden sich Hydroperoxide, die dann unter Abspaltung von Ethanolmolekülen zu größeren, explosiven
Aggregaten ("Etherperoxide") kondensieren.
Die Gefahr ist, dass sich die Peroxide beim Destillieren des Ethers anreichern, denn sie haben höhere Siedepunkte. Sie können dann explodieren.
Die Bildung von Peroxiden vermeidet man, indem man den Ether im Dunkeln und dazu auch noch über festem KOH stehen lässt. Mit KOH bilden sich schwerlösliche Salze der Hydroperoxide. Sie werden damit aus dem flüssigen Ether entfernt. Einmal werden sie der Polymerisation entzogen, andererseits reichern sie sich beim Destillieren des Ethers nicht mehr an. Wichtig ist aber, dass man vor dem Destillieren unbedingt die festen Bestandteile dieser Mischung abfiltriert!
Peroxide weist man zuverlässig durch Schütteln mit Kalium-Iodid-Lösungen anhand der Gelb- bis Braunfärbung nach. Man kann auch die Orangefärbung der Lösungen mit Titanylsulfat ausnutzen.
Die Zerstörung der Peroxide erreicht man durch starke Reduktionsmittel. Schaufeln Sie einfach Eisen(II)-Sulfat
hinein, rühren Sie gut um und lassen Sie das Ganze etwas stehen. Sie können es auch genau machen: Die Konzentration
sollte 5 g FeSO4 · 7 H2O in 20 ml Wasser zur Behandlung von einem Liter
Ether betragen. Sie können auch Ascorbinsäure nehmen.
Die Demonstration von Etherperoxiden im Unterricht würde ich an Ihrer Stelle vermeiden... Dazu haben wir eine
Webseite mit einer entsprechenden Abbildung.

Sicherheitsglasbrille mit Einschlag nach einer Furanexplosion
(Foto: Daggi)
Machen Sie auch keine Modellversuche! Mischen Sie keinesfalls andere Lösemittel mit Wasserstoffperoxid. Sie können ebenfalls hochexplosive Peroxide bilden, so zum Beispiel das Aceton.