 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1236
F: In ihrem Artikel zum Tipp des Monats Januar im Jahr 2001 haben sie
folgendes geschrieben:
- Versuch 3: Nebelbildung beim Öffnen einer Flasche mit CO2-haltigem Getränk
Nehmt eine neue Sprudelflasche, die unter Kohlenstoffdioxiddruck steht. (Ihr könnt dazu natürlich auch
eine Flasche des besten Champagners aus Papis Weinkeller auswählen...) Wenn ihr die mit einem Ruck aufdreht,
beobachtet ihr Nebelbildung im Dampfraum über der Flüssigkeit.
- Der Grund: Der Überdruck in der Flasche, der mehrere bar beträgt, wird auf den äußeren Luftdruck von einem bar entlastet. Das Flascheninnere kühlt sich ab und der bislang unsichtbare Wasserdampf kondensiert zu Nebel.
Nun habe ich vor ca einem halben Jahr auf einer ebenfalls wissenschaftlichen Homepage gelesen, dass dieser "Dampf" Trockeneisnebel ist, welcher aus dem, unter hohem Innendruck verfluessigtem CO2 aufgrund des raschen Druckabfalls und somit, die starke Abkuehlung entsteht.
Ist es moeglich, dass sich in einer handelsueblichen Getraenkeflasche (z.B Coca-Cola) genuegend Druck aufbaut, um minimale Mengen an CO2 zu verfluessigen?
Ich konnte leider den maximal Druck in einer norm Flasche mit Hilfe des Internets nicht ermitteln.
Ich habe lediglich geschlossen, dass der Energieauswand bei einem kalten, leicht geschuetteltem Getreank
(bei welchem gewoehnlicher Weise, der "Nebeleffekt" auftritt,) viel geringer ist, da das fluessige CO2 ja
schon vorgekuehlt waere und unter starkem Druck steht (falls der Druck zum verfluessigen ausreichend ist
(sie erwaehnten "mehrere bar" siehe oben)).
PS: Entschuldigen Sie bitte meine Umlautschreibweise, aber ich bin gerade als Austauschschueler in Venezuela und die Tastatur ist verschieden.
A: Der Druck von Champagner/Mineralwasserflaschen kann bis zu
5 bar betragen.
Dass es sich um bei diesem Druck verflüssigtes CO2 handelt, ist nicht richtig. Man muss hier
die kritischen Daten hinzuziehen: Reines CO2 hat die kritische Temperatur von 31 °C bei einem
Druck von 76,26 bar.
Die Temperatur von Trockeneis unter 1 atm Druck liegt bei -78,5 °C (Sublimationspunkt).
Beim Sekt handelt es sich dazu noch um eine verdünnte CO2-Lösung.
Bleiben Sie also ruhig bei meiner Erklärung...
1237
F: Ich habe eine frage zu den polyestern. und zwar frage ich mich
bzw. unser prof uns), warum dieser gegenüber säuren und basen empfindlich ist? kann dieser mit basen
verseifen? aber was passiert mit säuren?
A: Abstrahieren Sie erst mal von dem verwirrenden Zusatz "Poly-"!
Betrachten Sie die Synthese von einfachen Estern. Die erfolgt durch Protonenkatalyse. Dabei stellt sich
ein Gleichgewicht zwischen Esterbildung und -spaltung ein. Ester kann man also auch durch Säurenkatalyse
spalten.
Effektiver ist die Spaltung durch Basen oder besser durch Laugen, weil dann die Rückreaktion verhindert wird. Denn dabei entstehen ja die Säureanionen ("Seifen"), die nicht rückverestert werden können.
Aus diesem Grund können Sie z. B. PET oder Polycarbonate (PC) in Laugen oder Säuren zersetzen. Das spielt(e) beim chemischen Recycling eine wichtige Rolle. Dazu haben wir in unserem Bereich "Kunststoffchemie" Versuchsvorschriften.
Aber auch andere Kunststoffe wie PMMA (Plexiglas), die aus Estern bestehen, sind empfindlich gegenüber Säuren und Laugen. Das wissen die Leute, die entsprechend beschichtete Badewannen ihr eigen nennen...
Hat Ihr Prof das nicht gewusst?
1238
F: Ein befreundeter Kaufmann, der im Controlling bei einem
Getränkehersteller tätig ist, erläuterte mir, dass bei manchen Getränken, beispielsweise Apfelsaftschorle,
für Konservierungszwecke ein Stoff mit dem Namen "Velcuron" zugesetzt würde, der jedoch nicht in der
Zutatenliste auftauchen würde, da er sich innerhalb kürzester Zeit in (angeblich) "Nichts" auflösen
würde. Aufgrund dieses raschen Zerfalls in "Nichts" ( - ich vermute: einfache Salze, Wasser, o.ä.?)
nehme ich an, dass es sich dabei um keine komplexe organische Verbindung handeln kann.
Wissen Sie, welche Verbindung sich hinter dem Trivial- / Handelsnamen verbirgt?
A: Der Stoff heißt Velcorin (und nicht "Velcuron", wie in
der Frage!). Der systematische Name der Substanz ist Dimethyldicarbonat, ist also der Ester zwischen
Methanol und Kohlensäure. Dieser Stoff ist als konservierender Zusatz für Getränke zugelassen.
Hergestellt wird er durch Reaktion zwischen Phosgen und Methanol. Er zerfällt tatsächlich nach
sehr kurzer Zeit. Allerdings natürlich nicht in "Nichts", sondern in Kohlendioxid und - jetzt kommt's
- Methanol!
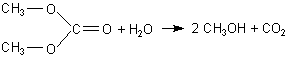
1239
F: Warum schwirren Fliegen sofort los, wenn man sie mit Zuckerwasser
füttert und Schmetterlinge bleiben sitzen?
A: Der Grund liegt im unterschiedlichen Stoffwechsel, der zur
Energiegewinnung dient.
Fliegen setzen Zucker direkt in Energie um.
Schmetterlinge machen aus Zucker erst Fette, die sie dann zur Energiegewinnung verbrennen. Das dauert eben.
1240
F: Ich habe eine Frage zum Thema Glycerin: Gibt es bei der Verbrennung
von Glycerin unter Sauerstoffmangel irgendwelche giftigen Nebenprodukte? (Ein Schüler hat mir die Frage gestellt
(dabei ging es um Rauchen von Wasserpfeifen, bei denen wohl Glycerin zum Tabak hinzugegeben wird) und ich finde
keine Antwort darauf). Prinzipiell ist Glycerin ja unbedenklich, aber ob bei Sauerstoffmangel Nebenprodukte
erntstehen können, da war ich so spontan doch überfragt.
A: Ein deutliches Ja! Glycerin bildet beim Erhitzen ungesättigte
Aldehyde mit hohem kanzerogenem Potential. Beispiel: Acrolein. Dieses stechend riechende und zu Tränen reizende
Gas können Sie den Schülern vorführen, indem Sie in einem RG Glycerin mit einer Portion KHSO4 erhitzen.
Dazu haben wir Texte in unserer Webseitengruppe zur Technischen Chemie ums Auto oder zur Atmosphärenchemie.
Viel wichtiger ist aber, dass Sie den Schülern klar machen, dass beim Rauchen immer kanzerogene polykondensierte
aromatische Kohlenwasserstoffe (PAK), gefäßaktives Nicotin und andere böse Substanzen entstehen. Da nützt auch die
"Rauchgaswäsche" nichts. Diese stellt sogar bei Müllverbrennungsanlagen nur eine grobe Primär-Maßnahme dar...