 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1346
F: Hallo Prof. Blume!! Im Prijektkurs an unserer Schule versuchen wir
(drei Schüler 13 Jhg) Biodiesel aus Rapsöl herzustellen. Dabei ensteht ja Glycerin. dieses Glycerin wollen
wir nun noch verwerten. Am liebsten hätten wir ein Produkt, welches kürzerkettiger als Glycerin ist und
vielleicht auch mit im Motor verbrannt werden kann. Wir haben schon so einiges ausprobiert, ohne Erfolg.
Nun ist unser Lehrer mit dem Latien am Ende. Können Sie uns helfen??
A: Man kann die C3-Kette des Glycerins nicht ohne
riesigen chemischen Syntheseaufwand um ein C-Atom verkürzen. Hier ist auch die Biodiesel-Industrie mit
ihrem Latein am Ende. Glycerin ist ein Problemstoff, weil man ihn in den bei der "Bio"-Dieselproduktion
anfallenden riesigen Mengen nicht benötigt. Das wird immer gern verschwiegen. Wenn der Biodiesel von EU
und Staat nicht so gewaltig subventioniert würde, würde kein vernünftiger Mensch mehr darüber reden...
1347
F: Woher kommt der Name Drews?
A: Ihr Name ist eine verkürzte Form von Andreas. Dazu gehört
auch Drees, Drewes und alles, was so ähnlich klingt oder geschrieben wird. Anders herum wurde natürlich
auch benannt: Andres, Anders(ch), Andy (usw.).
Im Englischen heißt Andreas "Andrew". Da steckt Ihr Name ja schon fast drin! Es gibt im Englischen auch die Kurzform Drew als Vorname - so heißt z. B. der Schauspieler, der den Freund von E. T. spielt.
Die wechselseitige Eindeutschung von Fremdnamen (meistens von Heiligen) wie Andreas war früher üblich. Aus Katharina wurden z. B. Trine und Rina, aber auch Kathrin, Kathie und Käte.
Aus Stefanie wurden Steffi oder Fanny.
1348
F: Warum bekommen verchromte Stoßstangen bei meinem Oldtimer so
leicht Pickel?
A: Die guten alten Stoßstangen bestanden früher aus Stahl, also
letztlich aus Eisen. Die waren verchromt. Obwohl Chrom entsprechend der Standardpotentials unedler sein
müsste als Eisen, neigt es zur Passivierung, das heißt, es überzieht sich mit einer äußerst dünnen, aber
zugleich sehr widerstandsfähigen und harten Oxidschicht, der vor weiterer Chromkorrosion schützt (wie
beim Aluminium). Dadurch bleibt nicht nur der Chromglanz erhalten. Außerdem schützt dieser Überzug
letztlich auch das unter dem Chrom liegende Eisen.
Wenn der Chromüberzug aber verletzt wird (z. B. durch Steinschlag), dann bilden sich Lokalelemente.
Der Grund: Beim galvanischen Auftrag der Chromschicht überzieht man das Eisenstück zuvor mit einer
Kupferschicht. Wird diese freigelegt, kommt es zu einer echten katalytischen Korrosionsförderung. Die
Rostbildung wandert unter dem passivierten und deshalb nicht angreifbaren Chromüberzug weiter. Da bei
der Rostbildung das Volumen zunimmt, kommt es zur Aufwölbung und zur bekannten Pickelbildung.
1349
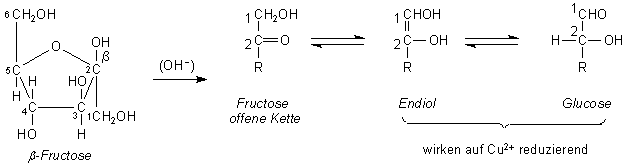
F: Warum wirkt auch Fructose mit Fehling-Lösungen - wenn auch viel
langsamer als Glucose? Die Ketogruppe sollte doch stabiler sein als die Aldehydgruppe. Denn wenn sie oxidiert
werden sollte, muss ja auch die C-C-Kette zerstört werden.
A: Es liegt nicht am Keton allein; Aceton reagiert nicht mit
Fehling. Fructose reagiert, weil sie sich zu leicht reduzierbaren Verbindungen umlagern kann. Hierzu
öffnet sich zunächst in alkalischen Milieu der Fehling-Lösungen der Furanring. Die nunmehr offenliegende
Ketogruppe in der Nachbarschaft einer Hydroxygruppe bildet ein Endiol - die wir auch von der Ascorbinsäure
her kennen. Die Endiolstruktur kann sich wiederum in eine Hydroxyl- und eine Aldehydgruppe umlagern. Die
Endiol- und die Aldehydgruppe reduzieren Kupfer(II)-Ionen zu Kupfer(I). Da die Umlagerung Zeit benötigt,
dauert die Reaktion mit Fructose länger als mit Glucose.
Man muss aber sagen, dass die Annahme, bei der Feling-Reaktion bildete sich aus der Glucose nur Glucuronsäure, stark vereinfacht ist. Im alkalischen Milieu bilden sich unter diesen Bedingungen viele Abbauprodukte der Glucose, u. a. auch zyklische Verbindungen.
1350
F: Betreff: Energiegewinnung bei Saccheromyces
Bisher habe ich meinen Schülern immer beigebracht, dass bei biologischen Prozessen die Abbauprodukte
energieärmer als die Edukte sein müssen.
Da die Brennwerte von Glukose ca. 410kcal/100g und von Ethanol ca. 710kcal/100g betragen, ist mir
der Energiegewinn der Hefepilze unverständlich. Auch Ihre mail-Antwort 886 hilft mir leider hier nicht
weiter.
Können Sie mein Weltbild wieder gerade richten?
A: Ihr Fehler ist erstens, dass Sie annehmen, dass die Hefe
aus 100 g Glucose 100 g Alkohol macht. Und zweitens: Rechnen Sie bitte statt Kcal/100 g mal alles in
Kcal pro Mol um! Dann werden Sie staunen...
Nun im Einzelnen: Die Reaktionsgleichung ist:
Glucose ——> 2 Ethanol + 2 CO2 + Energie
C6H12O6 ——> 2 C2H5OH + 2 CO2 + Energie
Aus einem Mol Glucose entstehen also 2 Mol Ethanol plus Oxidationsprodukte. Mit den Molmassen (180 g/mol für Glucose, 46 für Ethanol) berechnen wir die entstehenden Mengen: Aus 180 g Glucose werden 92 g Ethanol. Oder: 100 g Glucose werden 92/1,8 = 51 g Ethanol. Mit den Molmassen können wir auch die Energien bei einem Formelumsatz vergleichen:
180 g/mol · 4,10 Kcal/g ——> 738 Kcal/mol
2 · 46 g/mol · 7,10 Kcal/g ——> 653 Kcal/2 mol
Energiedifferenz: 85 Kcal/Formelumsatz
Sie sehen, dass Energie freigeworden ist; aber nur sehr wenig. Wir wissen ja, dass die Gärung für die Hefe tatsächlich ein schlechtes Geschäft ist...
Wenn Sie sich die obige Reaktionsgleichung ansehen, erkennen Sie, dass kein Wasserstoff verschwunden ist, sondern dass dieser nur umgeschichtet wurde. Gerade aus der Wasserstoffverbrennung beziehen atmende Organismen die meiste Energie.
Auch als (vermutlich) Biologielehrer sollten Sie sich angewöhnen, in Mol statt in Gramm zu denken/zu lehren. Mol ist eine der Teilchenzahl proportionale Größe, die dem Fakt, dass es große und kleine Teilchen gibt, Rechnung trägt.
Das gilt z. B. auch für die relativen Toxizitäten. Schauen Sie mal hierhinein: /dc2/dioxin/moltox.htm.