 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1581
F: Ich möchte gerne wissen, wie ich anhand eines Versuches den Kochsalzgehalt
in g in Salzstangen ermitteln kann. Vielleicht haben Sie ein paar tolle Vorschläge.
A: Es reicht nicht aus, das Salz einfach abzulösen und dann die abgetrennte
Lösung auskristallisieren zu lassen. Wegen der Löslichkeit von Bestandteilen des Teigs und anderer störender Stoffe
ist diese Probe viel zu verunreinigt und kann viel zu hohe Kochsalzwerte vortäuschen.
Insgesamt ist die Analyse vor allem wegen der Probenvorbereitung sehr aufwendig. Klassisch macht man es so: Man verascht
(das heißt: man verbrennt) eine abgewogene Salzstangen-Probe, nimmt die Asche auf und laugt sie mit destilliertem Wasser aus.
Dann kann man die Menge an Chlorid als Bestandteil des Kochsalzes bestimmen und daraus den Kochsalzgehalt berechnen. Die
Chloridmengenbestimmung erfolgt auf verschiedene Art und Weise: Durch Titration mit Silbernitratlösungen, oder man stellt
Silberchlorid her und wiegt die Menge ab (gravimetrisches Verfahren), oder man geht titrimetrisch vor (mit Silbernitrat).
Letzteres kann auch mit elektrochemischen Methoden gemacht werden, z. B. durch potentiometrische Titration. Man kennt
auch die Direktmessung mit ionensensitiven Elektroden, deren Membranen nur auf Chlorid ansprechen. Neben der
Ionenchromatographie ist die Atomabsorption eine weitere quantitative Methode.
1582
F1: Ich hoffe, dass sie mir meine Frage beantworten können, da ich zum Thema "ungesättigte
Fettsäuren" meine nächste Lehrprobe durchführen möchte.
Ich plane neben dem Nachweis der Doppelbindung mit Bromwasser auch auf Struktur-Eigenschafts-Beziehungen einzugehen. Bei dem
Vergleich der Ölsäure mit Stearinsäure wird in der Literatur der Knick im Molekül als Grund angeführt, warum Ölsäure bei Raumtemperatur
flüssig und Stearinsäure fest ist. So weit so gut.
Jetzt bin ich in unserer Chemie-Sammlung mehr zufällig auf Sorbinsäure gestoßen und wunderte mich darüber, dass diese Säure in einem Feststoffbehälter gelagert wird. Meine Verwunderung war noch größer, als ich feststellen musste, dass es sich tatsächlich um einen Feststoff handelt. Aufgrund der kurzen Kettenlänge (zum Vergleich: Capronsäure mit ebenfalls 6 C-Atomen ist bei Raumtemperatur flüssig) und der zusätzlichen Doppelbindungen hätte ich eher mit einem deutlich niedrigeren Schmelzpunkt gerechnet, aber bestimmt nicht mit 134 Grad Celsius. Damit ist die Regel, dass ungesättigte Fettsäuren aufgrund der gewinkelten Molekülstruktur (cis-Konfiguration vorausgesetzt) einen niedrigeren Schmelzpunkt haben als die gesättigten Alkansäuren, nicht mehr haltbar.
Ich wäre ihnen sehr dankbar, wenn sie mir bei dem Problem helfen könnten.
A1: Tatsächlich ist die Sorbinsäure zweifach ungesättigt. Ihre chemische Bezeichnung ist
(E,E)-2,4-Hexadiensäure. Dem entnehmen wir: Ihre Doppelbindungen sind trans-konfiguriert. Sie ist also eine trans,trans-Säure.

Dazu kommt noch, dass die beiden Doppelbindungen elektronisch wechselwirken (sie stehen in Konjugation). Das alles macht das Molekül
zu einem Stäbchen, das zudem an einem Ende stark polar ist und Wasserstoffbrücken ausbildet, was zu gut kristallisierenden
Kopf-an-Kopf-Dimeren führt.
Im Kristall werden die unpolaren Reste dazu noch durch van der Waals-Bindungen zusammengehalten. Da die Berührungszonen zwischen
den Ketten sehr groß sind, wirkt sich auch letztere Bindung recht stark auf den Zusammenhalt der Moleküle aus. Daher rührt der hohe
Schmelzpunkt.
Die Zick-Zack-Kette des von der Molekülgröße her vergleichbaren Capronsäuremoleküls weist dagegen keine starren Doppelbindungen auf. Es ist deshalb um alle Bindungen frei drehbar, so dass ein schlechtkristallisierendes Dimeren-Knäuel resultiert – mit niedrigem Schmelzpunkt.
Unsere Regel steht also nicht zur Diskussion. Denn die zweifach ungesättigten Fettsäuren sind cis-konfiguriert, sind also (Z,Z)- oder cis,cis-Säuren.
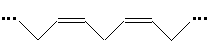
Außerdem sind ihre Doppelbindungen nicht konjugiert, so dass sich statt der Stäbchen auch hier leicht Knäuel bilden, deren Kristallisation nur schwer möglich ist. Daher der niedrige Schmelzpunkt.
F2: Vielen Dank für ihre schnelle und informative Antwort.
Ich hätte einfach nicht gedacht, dass der Unterschied zwischen Sorbinsäure und Capronsäure (ca. 140 Grad Differenz) so viel größer ist
als z.B. zwischen 1,3-Butadien und Butan (ca. 30 Grad Differenz).
Doppelbindungen können also einerseits zu höheren Anziehungskräften zwischen den Molekülen führen (in trans-Stellung; Beispiel Sorbinsäure)
und andererseits in cis-Konfiguration die Anziehungskräfte herabsetzen (Beispiel Ölsäure). Das ist wirklich interessant.
Nochmals vielen Dank für ihre Mühen und für ihr tolles Internetangebot, dass mir schon bei mancher Stundenvorbereitung sehr geholfen hat.
1583
F: Wir waren im April auf Sizilien, unter anderem auch, um den Ätna in Aktion zu sehen. Negativ.
Wir sahen nur einen eingeschneiten Gipfel und keine Spur von vulkanischer Aktivität. Unser italienischer Reiseleiter meinte, das läge
am Schnee, dass der den Berg abkühle.
Meinen Sie auch, dass das der Grund für die fehlende vulkanische Aktivität sein könnte?
A: Ich gehe davon aus, dass Sie mich mit dieser Frage nicht auf den Arm nehmen wollen.
Vulkanische Ausbrüche wirken auf Eis wie Schneidbrenner auf Butter. Ein richtiger Vulkanausbruch des Ätna würde Eis und Schnee
innerhalb von Minuten in reißende Schlammlawinen verwandeln. Denken Sie an den Ausbruch des Vulkans Grimsvötn unter Islands größtem
Gletscher (18.12.1998).
1584
F1: Betreff: Anfrage: Aschegehalt bei einer Leichenverbrennung
Ich komme mit einer nicht alltäglichen Frage zu Ihnen:
Durch einen Todesfall im Bekanntenkreis; mit einer Feuerbestattung, kam die Frage auf, wie hoch ist der Ascheanteil (in kg) bei einer Leichenverbrennung.
Beim Forschen im Internet habe ich keine Antwort gefunden.
Meine Frage lautet: Wie Kilogramme Asche bleiben bei einen 75 kg schweren Leiche (im Eichensarg) nach einer Feuerbestattung über?
Vielen Dank für Ihre Bemühungen.
A1: Sie stellen Fragen! Als ich Ihren Absender genauer unter die Lupe nahm, habe ich
festgestellt, dass Sie auf dem Baustoffsektor tätig sind. Sie wollen doch nicht etwa Ihren Opa Ihrem Beton zumischen und vermauern lassen?
Spaß beiseite. Ein lebender, erwachsener Mann von etwa 75 kg enthält ca. 3,7 kg anorganische Mineralstoffe. Man muss natürlich prüfen, was davon nach seiner Veraschung als Carbonat anfällt oder als Oxid. Das ist – wie beim Zementbrennen - bekanntlich eine Frage der Verbrennungstemperatur. Ähnlich sieht es mit dem Sarg aus.
Zu den praktischen Werten befragen Sie am besten einen Bestattungsunternehmer.
F2: Ich möchte mich bei Ihnen für die schnelle Antwort bedanken.
1585
F: Betreff: Nährwert von Brot durch einfache Kalorimetrie?
Sehr geehrter Herr Blume,
im Rahmen eines Projektunterrichts zum Thema 'Brot' wollten meine SchülerInnen Brot verbrennen. Ich habe die Idee aufgegriffen
und dachte, man könne den (ungefähren) Nährwert von Brot in einem einfachen Kalorimeter bestimmen. Die Anleitung habe ich in den
Anhang gestellt. Leider haben wir das Problem, dass sich das Brot so gut wie gar nicht zum Brennen bringen lässt. Haben Sie eine
Idee, wie man das bewerkstelligen könnte, ohne eine aufwändigere Apparatur zu benutzen (es handelt sich um einen 7. Jahrgang)?
Hoffnungsvolle Grüße, (…)
A: Da stellt sich die Frage: Wie machen es die Profis? Die müssen das Brot zuvor sehr gut
trocknen, dann etwas davon zu einer Pille pressen und in einer Sauerstoffatmosphäre (am besten unter hohem Druck, damit die
O2-Konzentration nicht zur begrenzenden Größe des Experiments wird) elektrisch zünden. Dann verbrennt das Brotstück
quantitativ.
Machen Sie es also ähnlich: Trocknen Sie Brot einige Tage lang, zerreiben Sie es und pressen Sie es zu Pellets. Die sollte man anzünden können. Vielleicht hilft ein Tropfen (nicht mehr!) Alkohol als Zündhilfe.
Übrigens funktioniert der Versuch sehr gut ohne weitere Vorbereitung mit Schokolade.
Erwarten Sie aber hinsichtlich der Energiemenge nicht allzu viel Aussagekraft.