 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
2131
F: Was ist Glyphosat?
A: Glyphosat ist der Wirkstoff des unter der Bezeichnung Roundup® vertriebenen Pflanzengifts
(Herbizid).
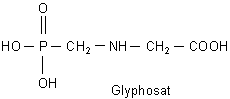
Der chemische Name dieser Verbindung ist N-(Phosphono-methyl)-glycin. Es wird nicht als freie Säure, sondern in der Form des Isopropylamin-Salzes angewandt.
Obwohl es seit 1971 vertrieben wird, ist es erst heute wegen möglicher krebsfördernder Eigenschaften ins Gerede gekommen.
2132
F: Was ist das für ein Stoff, den die Leute in dem Bonner Schuppen gefunden haben? Es soll sich um ein
Nitrophenol handeln. Gibt es einen Zusammenhang mit Pikrinsäure?
A: Wegen der Bedeutung des Themas haben wir aus der Antwort einen Tipp des Monats gemacht.
2133
F1: In der Chemikalien-Sammlung unserer Schule findet sich schwarz angelaufenes Magnesium (als Band
oder Späne). Welche Verbindung mag das sein, das Oxid und das Carbonat sind doch weiß?
A1: Dafür gibt es verschiedene Gründe.
Magnesium ist zwar ein sehr unedles Metall, das mit allem reagieren sollte, was so in der Laborluft herumschwebt. So bildet Magnesium nicht nur Carbonate und Oxide, sondern durchaus auch Sulfide. Mg ist aber erstaunlich stabil, denn es wird wie Aluminium durch eine stabile Oxid/Carbonatschicht geschützt („Passivierung“). Diese Beläge sollten eigentlich alle farblos sein. Hinzu kommen in der Laborluft viele organische Verbindungen, die - wenn auch langsam - mit Mg (unter Mitwirkung von MgO) unter Oxidation reagieren. Weil diese Reaktionsprodukte in allen möglichen Bereichen des sichtbaren Spektralbereichs absorbieren, kommen die Dunkelfärbungen zustande. Es kann mit der langen Zeit auch zur Bildung von Kohlenstoff kommen. Mg reduziert (wenn auch nur sehr langsam bei Zimmertemperatur) sogar CO2 zu schwarzem Kohlenstoff.
Aber wichtiger ist wohl Folgendes: Magnesium-Bänder und -Späne enthalten als Verunreinigungen Fremd-Metalle, wenn auch nur in Spuren. Beispiele sind die Schwermetalle Cu, Fe und Pb. Diese stören die Passivierung des Magnesiums und bilden dazu noch schwarze Oxide bzw. Sulfide. Das beobachten wir auch beim Recycling-Aluminium, das oft Kupferspuren enthält.
Sie müssen also in erster Linie darauf achten, dass das Mg luftdicht verpackt ist - auch wenn das unter den Bedingungen eines Schullabors nur schwer zu bewerkstelligen zu sein scheint…
F2: Herzlichen Dank für die ausführliche Antwort, an Kohlenstoff hatte ich auch schon gedacht, die
Verunreinigungen und deren Verbindungen hatte ich nicht bedacht. Das Hauptproblem der Chemikalien in den Schulen ist ja auch, dass sie ewig lange
halten, weil man immer nur kleine Mengen benötigt, im Labor an der Uni für die Grignard-Reaktionen hatten wir einen ganz anderen Durchsatz.
2134
F: Mein Sohn ist an Klarzell-Sarkom erkrankt. Jemand verbreitet die Meinung, dass die Krankheit
auf einen Gen-Defekt meiner Familie zurückzuführen sei. Kann das sein?
A: Histologische Untersuchungsberichte zu diesem Sarkom („Malignes Melanom der Weichteile“) sprechen
tatsächlich von einem „Nachweis einer Translokation im Bereich von Chromosom 22“. Der Nachweis dieser Genveränderung auf Chromosom 22 gilt
sogar als wichtiger Beweis dafür, dass die histologischen Befunde für das Klarzell-Sarkom stimmen. Das heißt aber nicht, dass Sie einen
Erbfehler mit sich herumtragen.
Bei der Translokation (Umgruppierung) von Genen zwischen Chromosomen handelt es sich um eine Schädigung des Erbguts (Chromosomen-Mutation), die durch äußere Einflüsse wie UV-Einstrahlung (z. B. auch beim schwarzen Hautkrebs, dem malignen Melanom), Einwirkung von Chemikalien, mechanische Dauerreize und so weiter eintreten kann. Es reicht aus, dass eine einzige Zelle diesen Gendefekt entwickelt, um als Startzelle für die Sarkombildung zu dienen. Denn die Mutation bewirkt, dass die Zelle beginnt, unkontrolliert zu wachsen und sich zu vermehren. Normalerweise wird das jedoch vom Immunapparat oder von den „Reparaturdiensten“ des Zellkerns sofort erkannt und niedergekämpft. Auf diese Weise werden täglich viele Tausend Zell-Entartungen, die zu Krebserkrankungen führen könnten, verhindert. Das ist bei den 14 Billionen Zellen, aus denen ein Mensch besteht, keine große Zahl.
Vielleicht haben Stress in Beruf und Ehe (Scheidung) den Immunapparat unterdrückt - eine bekannte Folge der Ausschüttung von Cortison und anderen Stresshormonen.
Zurück zu Ihrer Anfrage: Wenn Ihre Familie einen entsprechenden dominanten Gen-Defekt in sich tragen würde, wäre Sie allesamt an Klarzell-Sarkom erkrankt.
2135
F: Bei einem Unglück auf der Autobahn ist ein Laster mit flüssigem Aluminium umgekippt. Das Aluminium
war dem Vernehmen nach 800 °C heiß. Es wurde, wie man im Fernsehen sehen konnte, mit Wasser abgekühlt. Warum gab es keine Explosion. Thermit
z. B. darf man aus diesem Grunde auf keinen Fall mit Wasser löschen. Und wie ist das mit brennendem Öl?
A: Explosionen als Auswirkung von Wassereinsatz haben zwei Gründe:
1. Wasser vermischt sich unter Emulsionsbildung etwas mit dem heißen Öl, verdampft schlagartig und reißt das brennende Material mit sich. Das ist der Fall beim Löschen eines Friteusenbrandes.
2. Beim Thermit-Versuch entwickelt sich eine derartige Hitze, dass sogar Eisen (Schmelzpunkt: 1535 °C) verflüssigt wird. Bei den sehr hohen Temperaturen wird Wasserdampf zum Teil thermisch zersetzt:
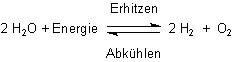
Diese Zersetzung macht sich ab etwa 2000 °C im Prozentbereich bemerkbar.
Das so gebildete Produktgemisch kennen wir als Knallgas. Es explodiert während seiner Abkühlung auf Temperaturen, die unter dem Zersetzungsbereich liegen. Die dabei ablaufende Ketten-Reaktion wird durch in der Hitze gebildete Radikale wie H• und OH• gefördert.
Bleibt noch die Betrachtung der Verhältnisse bei dem flüssigen, 800 Grad heißen Aluminium, das bei dieser Temperatur (noch) nicht brennt.
1. Beim Aufspritzen von Wasser wird es nicht mit dem Wasserdampf mitgerissen, da es sich überhaupt nicht mit dem Wasser vermischt.
2. Für die thermische Zersetzung von Wasser unter Knallgasbildung ist die Temperatur viel zu niedrig.