
Was ist Glas?
Experimente:
Versuch: Schmelzen und Bearbeiten von Glas
Versuch: Borax- und Phosphorsalzperlen in der Analytik
Versuch: Tiefkühlen von Gummi
Versuch: Schmelzen von Kaliumnitrat
Versuch: Vergleich der Härte von Glas und Quarz
Klick mich an!
Bild 1: Ein Stück Glas und ein Kalkspatkristall (Höhe 10 cm)
(Foto: Blume)
Definition:
Glas ist ein stofflich einheitliches Schmelzprodukt, das abgekühlt und
erstarrt ist, ohne merklich zu kristallisieren. Gläser schmelzen nicht bei
einer bestimmten Temperatur, sondern werden über einen weiten
Temperaturbereich weich (siehe Experimente, V 4). Man
nennt diese Substanzen auch amorph (griech. a: nicht, morphe:
Gestalt; also formlos, gestaltlos). Treffend spricht man auch von einer
unterkühlten Schmelze oder vom plastischen Zustand.
Glas-Eigenschaften haben viele anorganische Stoffe wie z. B. Schmelzen von Boraten oder Phosphaten, die in der klassischen Analytik eine wichtige Rolle spielten (siehe Experimente, V 1). Natürlich ist das Glas selbst zu nennen. Hierzu gehört aber auch der aufgeschmolzene Quarz, der rasch abkühlt. Sogar unter den organischen Stoffen findet man Gläser: Das sind vor allem Kunststoffe wie das Plexiglas oder PVC ohne Weichmacherzusatz. Sogar tiefgekühltes Gummi hat glasartige Eigenschaften (siehe Experimente, V 2).
Typisch für Gläser ist der plastische Zustand in gewissen Temperaturbereichen. Dieser liegt energetisch zwischen den Aggregatzuständen Fest und Flüssig.
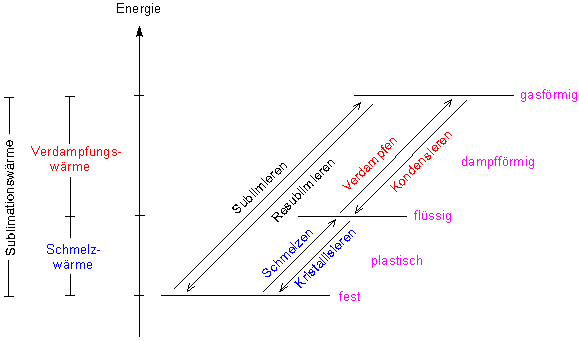
Bild 2: Energiediagramm der Aggregatzustände
Die Eigenschaften von kristallinen Festkörpern und Gläsern lassen sich wie folgt
unterscheiden:
Nicht plastische Stoffe:
Plastische Stoffe:
Zum Verständnis der Eigenschaften von Glas wollen wir den molekularen Aufbau von zwei Feststoffen vergleichen:
Natriumchlorid NaCl ist einheitlich aus Na+- und Cl¯-Ionen aufgebaut (Ionengitter; im Versuch 3 nehmen wir aus Gründen der Schmelzbarkeit das analoge Kaliumnitrat). Jedes Ion hat räumlich und energetisch exakt die gleiche Umgebung. Alle Ionen werden deshalb beim Erreichen eines bestimmten Energiegehaltes (charakterisiert durch eine präzise Temperatur) schlagartig aus der Bindung gelöst. Folglich beobachtet man einen scharfen Schmelzpunkt von 801 °C (bzw. 339 °C im Versuch 3). Der Vorgang ist reversibel.
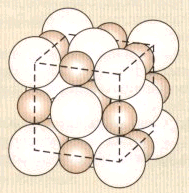
Bild 3: NaCl-Gitter (© Cornelsen)
Einen scharfen Schmelzpunkt beobachtet man auch beim natürlichen Quarz
SiO2, der völlig symmetrisch
aus Si- und O-Atomen aufgebaut ist (siehe Bild). Man kennt die kristalline Form als
Bergkristall. Hier handelt es sich nicht um ein Ionengitter, sondern um ein
Makromolekülgitter. Auch hier hat jeder Bausteintyp räumlich und energetisch exakt
eine gleiche Umgebung. Quarz schmilzt deshalb scharf bei 1705 °C. Lässt man die
Quarzschmelze abkühlen, können sich die kovalent gebundenen Bausteine nicht mehr
regelmäßig zusammenfügen. Es existieren keine gleichen Umgebungen bzw.
Bindungswinkel/Bindungslängen mehr (siehe Bild). Deshalb brechen beim erneuten Schmelzen
einzelne Bindungen nacheinander auf. Man beobachtet folglich keinen scharfen
Schmelzpunkt mehr, sondern das für Gläser typische Erweichen. Ein chemisch
einfacher Glastyp, Quarzglas, ist entstanden.
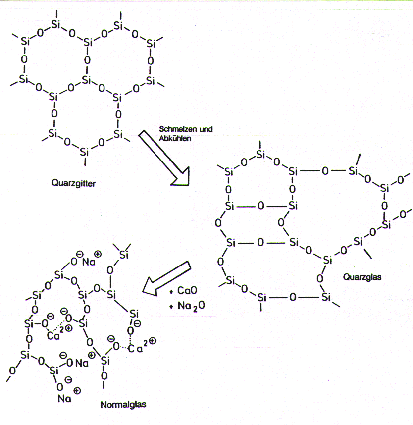
Bild 4: Quarzgitter (Tridymit), Quarzglas und Normalglas
(Aus Übersichtsgründen wurden nur drei Bindungen des Siliciums gezeichnet.)
Grundsätzlich ähnelt der Aufbau von Glas dem
ungeregelten Bau von Quarzglas. Das Normalglas
stellt man aus Quarz, Kalk und Soda bzw. Pottasche her. Mischungen dieser drei
Stoffe werden gesintert und dann zusammengeschmolzen.
Quarz stellt auch hier das Netzwerk als Grundmatrix (Quarz ist Netzwerkbildner). Die
Alkali- und Erdalkaliverbindungen brechen das Gitter vollkommen ungeregelt auf (Bild;
sie sind Netzwerkstörer). Dabei bilden sich nichtkristalline Silicate. Jeder Baustein
hat nun Umgebungen mit unterschiedlichen Bindungsbedingungen aufzuweisen. Die Folge ist,
dass die Bindungen bei Energiezufuhr nicht mehr simultan, sondern nacheinander
aufbrechen. Dies ist der Grund für den weiten Erweichungsbereich von Glas.
Die chemischen Unterschiede zwischen Quarz und Glas wirken sich auch in der mechanischen Stabilität aus. Glas ist "weicher" als Quarz. So kann man Glas mit einem Bergkristall, also reinem Quarz, anritzen (siehe Experimente, V 20). Gleiches gelingt auch mit Feuerstein, der ebenfalls aus reinem, allerdings fein verteiltem Quarz besteht.
(Kunststoffgläser bestehen aus polymeren Makromolekülen. Hier wird die glasartige Eigenschaft durch verschieden starke van der Waals-Bindungen erreicht. Allerdings hat die Bearbeitbarkeit von organischen Gläsern ihre Grenzen: Beim Aufschmelzen von Kunststoffgläsern besteht Zersetzungsgefahr. PMMA zersetzt sich sogar völlig - das bringt natürlich Vorteile beim Recyceln (siehe Experimente, V 17).)
Weitere Texte zum Thema „Glas“