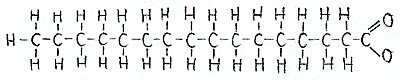
1.2 Die Chemie der Seifentenside
Im Unterricht der 2. Klasse, in der die Reihe zum Thema "Waschen und Reinigen" erprobt wurde, lernten die Schüler den vereinfachten Begriff der "Seifenteilchen" kennen, die in der Chemie als "Tenside" bezeichnet werden. Das rein chemische Themengebiet der Tenside im Zusammenhang mit Seifen und Waschmitteln wird normalerweise erst im 9. oder 10. Schuljahr, also zum Ende der Sekundarstufe I, eingeführt. Dabei lernen die Schüler den Aufbau und die Wirkungsweise der Tenside auf molekularer Ebene kennen. Sie erfahren im Chemieunterricht, dass bei der Erhitzung von Fett mit einer verdünnten Lauge eine Reaktion stattfindet, die man Verseifung nennt.
Fett + Wasser ———> Glycerin + Fettsäuren
Bei diesem Vorgang werden die Fette in ihre Ausgangsstoffe Glycerin und Fettsäuren zerlegt, wobei die Fettsäuren durch die Lauge sofort neutralisiert werden. Durch die Neutralisation entstehen daraus wasserlösliche Salze, die Seifen.
Fettsäuren + Laugen ———> Seifen
Wenn an der Reaktion Natronlauge beteiligt ist, entstehen Natriumsalze der Fettsäuren. Sie bilden die feste Kernseife. Wird jedoch Kalilauge eingesetzt, entstehen Kaliumsalze der Fettsäuren, so dass die Seife dann zähflüssig ist und als Schmierseife bezeichnet wird. Lösen wir diese Seifen im Wasser, bilden sich Ionen. Bei Kernseife bilden sich Natrium- und Säurerestionen, wohingegen bei der Schmierseife Kalium- und Säurerestionen entstehen. Die Säurerestionen, die auch "Seifenanionen" genannt werden, bestehen hauptsächlich aus einer langen Kohlenwasserstoffkette, die sich wasserfeindlich verhält. Das Ende der Kette verhält sich dagegen äußerst wasserfreundlich.
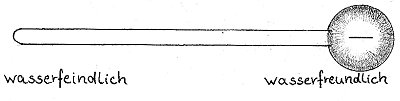
Der wasserfeindliche Teil wird aus dem Wasser herausgedrängt, so dass sich die Seifenanionen zunächst an der Wasseroberfläche anlagern. Danach bilden sich Ansammlungen von Seifenanionen auch im Wasser.
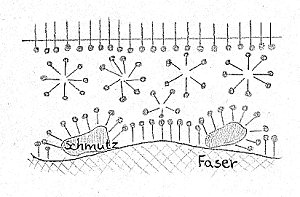
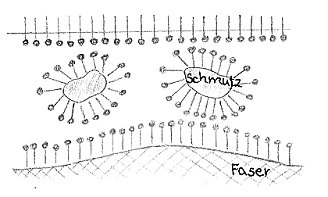
Die Seifen setzen dadurch augenblicklich die Oberflächenspannung herab, und können außerdem Fette im Wasser lösen, was beim Waschen erforderlich ist. Da Seife jedoch alkalisch wirkt, werden Stoffe wie Wolle beim Reinigen stark angegriffen. Zusätzlich erlischt die Waschwirkung in hartem Wasser, da sich mit Calcium- und Magnesiumionen unlösliche Kalkseifen bilden, die sich im Gewebe absetzen. Um diese Nachteile beim Einsatz von Seifen beim Waschen vorzubeugen, wurden Stoffe mit einem ähnlichen Aufbau wie den Seifenanionen entwickelt, die Tenside (waschaktive Substanzen). Tenside setzen ebenfalls die Oberflächenspannung herab, reagieren aber neutral. Sie werden in Waschmitteln verwendet und haben die Seifen beim Wäschewaschen fast vollständig verdrängt. [7]