Die Struktur der H2O2-Moleküle
Wenn es um H2O2 geht, denkt man an die Schwester H2O. Aber man sollte auch O2 im Blick behalten. Denn H2O2 steht, zumindest was die Oxidationszahl des Sauerstoffs und die Struktur angeht, zwischen den beiden.
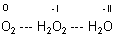
Entsprechend sehen die groben Strukturen der drei Spezies aus, wie sie sich der eine oder andere Schüler vorstellt.
Die rot gezeichneten Strukturen sind mehr oder weniger richtig.
Es ist also – wie immer in der Chemie - nicht alles, wie man es sich vorstellt, sondern oftmals ganz anders…:
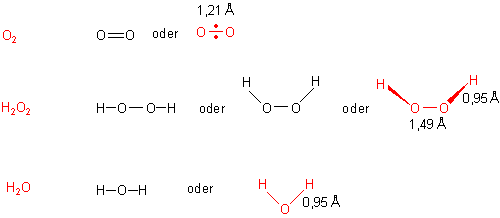
Das Sauerstoffmolekül weist keineswegs eine Doppelbindung auf. Es ist vielmehr ein Biradikal.
Dass das Wassermolekül gewinkelt ist, ist wohl allgemein bekannt. Der Winkel H-O-H ist nicht genau ein Tetraederwinkel, da die nichtbindenden Elektronenpaare größere Orbitale bilden als die bindenden. Deshalb werden die bindenden Elektronenpaare und damit auch die Wasserstoffatome etwas "zusammengedrückt". Der Winkel beträgt statt theoretischen 109,5 ° nur 104,5 °.
Der Bindungswinkel H-O-O im Molekül von H2O2 beträgt nur noch 94,8 °. Das Molekül ist auch nicht planar gebaut, sondern in sich verdreht. Dieser so genannte Dieder-Winkel um die O-O-Achse beträgt 111,5 °.
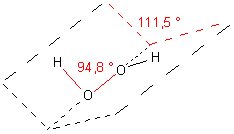
Nur so ist die wechselseitige Abstoßung der H-Atome und der ausladenden nichtbindenden sp3-Orbitale am geringsten.
Natürlich können die beiden Hydroxyl-Gruppen des Moleküls intern um die O-O-Achse rotieren. Aber das geht nicht so einfach und erfordert Energie, um die Abstoßungen der einander gegenüberliegenden H-Atome und der nichtbindenden Orbitale zu überwinden.
Das Kalottenmodell von H2O2 sieht folglich so aus:

(Fotos: Blume)
Weitere Texte zum Thema „Wasserstoffperoxid“