Versuch: Untersuchen von Kernseife auf die Elemente
Kohlenstoff und Wasserstoff
Schülerversuch; 20 min.
Beim Experimentieren den Allgemeinen Warnhinweis unbedingt beachten.
Geräte
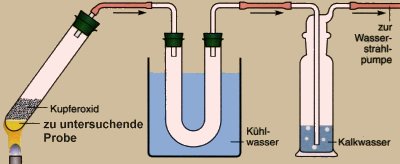
Reagenzglas (schwerschmelzbar), U-Rohr, Waschflasche,
Stativ, Wasserstrahlpumpe, Bunsenbrenner.
Chemikalien
Kernseife, Kupfer(II)-oxid, Kalkwasser (C),
Cobaltchlorid-Papier (T).
Durchführung
1 g Kernseife wird in ein Reagenzglas gegeben
und mit Kupfer(II)-oxid 4 cm hoch überschichtet. Der Inhalt des
Reagenzglases wird erhitzt und die Reaktionsprodukte, wie in der Abbildung
gezeigt, aufgefangen.

(Quelle: [1])
Beobachtung
Im U-Rohr kondensiert Wasser, welches mit Cobaltchlorid-Papier
nachgewiesen wird.
In der Waschflasche mit Kalkwasser bildet sich ein weißer
Niederschlag.
Auswertung
Die in der Kernseife enthaltenen Wasserstoff- und
Kohlenstoffatome werden oxidiert:
4 H + O2 ———> 2 H2O
C + O2 ———> CO2
Gleichzeitig wird das Kupfer(II)-oxid (Oxidationsmittel), welches den Sauerstoff für die Oxidationsreaktionen liefert, selbst zu Kupfer reduziert:
2 CuO ———> 2 Cu + O2
Cobaltchlorid-Papier enthält blaues Cobalt(II)-tetrachlorocobaltat(II), welches mit Wasser den rosafarbenen Hexaquocobalt(II)-chlorid-Komplex bildet:
Co[CoCl4] + 12 H2O ———> 2 [Co(H2O)6]Cl2
Kohlenstoffdioxid bildet mit Kalkwasser einen weißen Niederschlag aus feinverteiltem Calciumcarbonat:
CO2 + Ca(OH)2 ———> CaCO3 + H2O