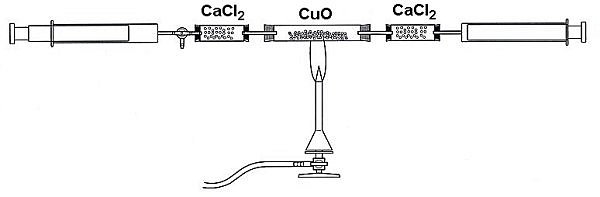
Versuch: Identifizieren von Camping-Gas durch quantitative Verbrennung
Lehrerversuch; 15 min.
Beim Experimentieren den Allgemeinen Warnhinweis unbedingt beachten.
Geräte
2 Kolbenprober (100 ml), Dreiwegehahn, 2 Trockenrohre (mit Calciumchlorid), Quarzglas-Reaktionsrohr,
Stopfen, Glasrohre, Gummischlauch, Stative, Muffen, Klemmen, Bunsenbrenner.
Chemikalien
Camping-Gas (F), Stickstoff (Druckgasflasche), Kupfer(II)-oxid-Drahtnetz.
Durchführung
Die Versuchsapparatur wird, wie in der Abbildung
dargestellt, aufgebaut. Anschließend wird die gesamte
Apparatur mit Stickstoff gespült. Aus einer Campingkocher-Kartusche
füllt man dann 20 ml Gas in die Versuchsapparatur.
Das Kupfer(II)-oxid wird mit dem Bunsenbrenner erhitzt und
das Camping-Gas mit den Kolbenprobern wiederholt darüber
geleitet, bis keine Volumenzunahme mehr erfolgt. Die Apparatur
kühlt nun ab und das neue Volumen wird abgelesen.

(Graphik: Wolfgang)
Beobachtung
Es hat eine Volumenzunahme von 20 ml auf 80 ml stattgefunden.
Auswertung
Camping-Gas ist ein gasförmiger Kohlenwasserstoff.
Bei der Oxidation von Kohlenwasserstoffen entsteht neben Wasser
auch Kohlenstoffdioxid. Das Kupfer(II)-oxid selbst wird zu elementarem
Kupfer reduziert. Damit ist Kohlendioxid das einzige entstehende
Gas bei dieser Reaktion und muss deshalb auch für die
Volumenzunahme verantwortlich sein. Nach der Avogadro-Regel
entstehen aus einem Mol Kohlenstoff bei vollständiger
Verbrennung 1 Mol Kohlendioxid, so dass sich für
die Oxidation des Camping-Gases folgende allgemeine
Reaktionsgleichung formulieren lässt:
![]()
Nach dieser Formel entstehen aus n Mol Kohlenstoffatomen n
Mol Kohlenstoffdioxidgas. Da aus 20 ml Camping-Gas 80 ml Kohlenstoffdioxidgas
entstanden sind, müssen die Camping-Gas-Moleküle die
vierfache Menge an Kohlenstoffatomen enthalten, wie Kohlenstoffdioxid,
also vier.
Hieraus kann geschlossen werden, dass Camping-Gas aus
Butangas besteht:
C4H10 + 13 Cu à 4 CO2 + 5 H2O + 13 Cu