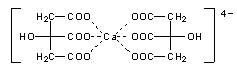
Versuch: Der Einfluss von Hydroxycarbonsäuren auf den Zahnschmelz (Modellversuch)
Schülerversuch 5 min; Lehrerversuch 15 min.
Beim Experimentieren den Allgemeinen Warnhinweis unbedingt beachten.
Geräte
Saftpresse, Vorrichtung zum Abnutschen, Becherglas
(200 ml), Siedesteinchen, Dreifuß, Bunsenbrenner.
Chemikalien
2 Zitronen, calciumhaltiges Mineralwasser, konzentrierte Ammoniaklösung
(C), Calciumchloridlösung (w = 10 %, Xi).
Durchführung
a) Man beißt mit den Schneidezähnen in eine
geschälte Zitrone und streift anschließend mit der
Zunge über die Zähne. Dann spült man den Mund gut
mit Mineralwasser aus, und testet die Zahnoberfläche erneut.
b) Zuerst wird eine Zitrone ausgepresst und der Saft mit einer großen Nutsche abfiltriert. Dann wird so lange konzentrierte Ammoniaklösung hinzugegeben, bis die Lösung deutlich basisch reagiert. Zu 20 ml der quittegelben Lösung werden nun 10 ml der Calciumchloridlösung gegeben. Die klare Lösung wird über dem Gasbrenner mit Siedesteinchen erhitzt. Dabei bildet sich langsam ein flockiger, weißer Niederschlag.
Auswertung
Zur Chemie der Citronensäure haben wir eine besondere Webseitengruppe.
Hier soll deshalb nur kurz auf die Hintergründe des Versuchs eingegangen werden.
Eine besondere Eigenschaft einiger Hydroxycarbonsäuren (z. B. Citronensäure) ist das Komplexieren von Metall-Ionen,
wie z. B. die von Calcium.
Der Zahnschmelz besteht aus hartem Calciumphosphat, dem z. B. durch Citronensäure die Calcium-Ionen entzogen werden
können. Hierbei entsteht der lösliche Calciumdicitrat-Komplex.
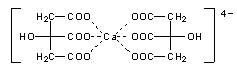
Die Zähne fühlen sich deshalb nach dem Beißen in einen Zitrone stumpf an. Durch Mineralwasser wie Gerolsteiner, das reich an Calcium-Ionen ist, wird einerseits die Säure neutralisiert und ausgespült. Anderseits werden die Calcium-Ionen dem Zahnschmelz unter Wiederherstellung einer glatten Zahnoberfläche zurückgegeben (Teilversuch a).
Im Teilversuch b) wird der Calciumdicitrat-Komplex durch direkte Reaktion zwischen Citronensäure (bzw. Citrat-Anionen) und Calcium-Ionen hergestellt. Dieser Komplex ist allerdings nur in der Kälte löslich. Beim Erhitzen bildet sich daraus ein weißer Niederschlag: Schwerlösliches Calciumcitrat.
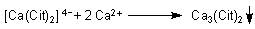
Literatur
R. Blume und Kollegen, Chemie für Gymnasien, Organische Chemie Themenheft 3,
Cornelsen Verlag, Berlin 1994, 15.