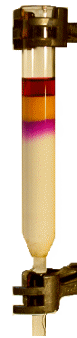
Wie funktioniert ein Ionenaustauscher?
Experimente:
Versuch: Demonstration der Trennung von Permanganat-
und Chromat-Ionen an Aluminiumoxid
Versuch: Beladen eines Ionenaustauschers mit Kupfer-Ionen
Versuch: Regenerieren eines zuvor beladenen Ionenaustauschers mit
Schwefelsäure
Vereinfacht ausgedrückt
Der Ionenaustausch folgt dem Gesetz der Natur: "Der Stärkere verdrängt den
Schwächeren", d. h. die höherwertigen Ionen verdrängen die niederwertigen Ionen vom Austauscher
durch ihre größere "Bindekraft" (elektrostatische Anziehungskraft oder auch Coulomb-Kraft
genannt) zu ihm.
| Beispiele: | Al3+ verdrängt Ca2+,
Ca2+ verdrängt Na+ vom Kationenaustauscher.
PO43- verdrängt SO42-, SO42- verdrängt Cl- vom Anionenaustauscher. |
Unter gleichrangigen Ionen verdrängt der Schwerere, d. h. das Ion mit der höheren Molekularmasse (m), den Leichteren, d. h. das Ion mit niedrigerer Molekularmasse.
| Beispiel: | K+ (m = 39 g/mol) verdrängt Na+
(m = 23 g/mol), Na+ (m = 23 g/mol) verdrängt H+ (m = 1 g/mol) vom
Kationenaustauscher.
I- (m = 127 g/mol) verdrängt NO3- (m = 62 g/mol), NO3- (m = 62 g/mol) verdrängt OH- (m = 17 g/mol) vom Anionenaustauscher. |
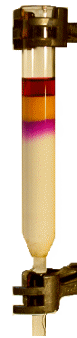
Der Fachbegriff für diese Rangfolge bzw. Verdrängungsvorgänge heißt
Selektivität. Es gibt Ionen mit unterschiedlicher
Selektivität zum Ionenaustauscher und umgekehrt Ionenaustauscher mit unterschiedlicher
Selektivität für ein Ion.
Die Selektivität für einen Ionenaustauscher zu zwei unterschiedlich geladenen Anionen lässt sich bei
der Trennung von MnO4-- und CrO42--Ionen an Aluminiumoxid
(Al2O3) demonstrieren (-> Versuch). Aluminiumoxid
hat wegen seines stark polaren Aufbaus, an dem Al3+-Ionen beteiligt sind, neben seinen
Adsorptions-Eigenschaften auch Anionenaustauscher-Eigenschaften. Außerdem ist wegen der weißen Farbe
von Al2O3 die Auftrennung der gelben Chromat-Ionen und violetten Permanganat-Ionen
gut zu beobachten (siehe Bild rechts). Die zweifach negativ geladenen Chromat-Ionen bleiben
stärker an der Aluminiumoxid-Schicht "hängen". Die einfach negativ geladenen
Permanganat-Ionen werden weniger stark festgehalten. Im Bezug auf Aluminiumoxid besitzt das
Chromat-Ion also eine höhere Selektivität als das Permanganat-Ion.
Der Fachausdruck für eine Reaktion, bei der weniger selektive Ionen von selektiveren Ionen verdrängt
werden, heißt Beladung.
Wenn das alles wäre, könnte ein Ionenaustauscher nur solange benutzt werden, bis er mit der
selektivsten Ionenart vollständig beladen ist. Aus der Praxis weist du bestimmt, dass Ionenaustauscher
immer wieder verwendet werden können. Es muss also eine Methode geben, die stärker gebundenen
(selektiveren) Ionen vom Ionenaustauscher zu verdrängen. Auch dieser Vorgang folgt, vereinfacht
gesagt, dem Gesetz der Natur: "Viele Schwächere verdrängen einen Stärkeren."
Zu diesem Zweck wird der Ionenaustauscher mit einer konzentrierten Lösung der Ionen behandelt, die bei
der Beladung zuvor verdrängt worden sind. Für diese Reaktion, bei der einige selektive Ionen durch viele weniger
selektive Ionen verdrängt werden, heißt Regeneration.
Formulierst du das Beladen und das Regenerieren eines Ionenaustauschers in einer chemischen Gleichung, so erkennst du, dass es sich bei der Ionenaustausch-Reaktion um eine Gleichgewichtsreaktion handelt. Dabei ist die Lage des Gleichgewichts durch die Selektivität des Ionenaustauschers für die jeweiligen Ionenarten und durch die Konzentration der Ionen in der Elektrolytlösung gekennzeichnet.
Beladen (-> Versuch):
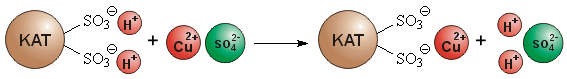
Regenerieren (-> Versuch):
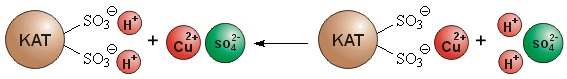
Unterschied zwischen Adsorption und Ionenaustausch
Wenn Gase, Dämpfe oder die in Flüssigkeit gelösten Stoffe durch Adhäsion
(d. h. allein durch die Oberflächenkräfte und nicht durch Kovalente- oder Ionen-Bindungen) festgehalten
werden, bezeichnet man dies als Adsorption. Das Festhalten von geladenen
Stoffen durch Ionenaustausch erfolgt dagegen, wie du bereits oben lesen
konntest, durch die Coulomb-Kräfte. Durch Adsorption gebundene Teilchen
lassen sich durch Waschen wieder ablösen, durch Ionenaustausch gebundene Teilchen hingegen nicht.
Wie auch bei den chemischen Bindungen ist der Übergang von der Adsorption zum Ionenaustausch fließend.
Wann ein Ionenaustausch und wann eine Adsorption für das Festhalten eines Stoffes verantwortlich ist, kann
in vielen Fällen nicht eindeutig erkannt werden. Fast immer sind beide Mechanismen (Adsorption und
Ionenaustausch) gleichzeitig nebeneinander wirksam.
Noch einige Begriffe
Wenn man einen Ionenaustauscher mit Lösungen der Gegen-Ionen behandelt, spricht man von Eluieren;
die austropfende und aufzufangende Lösung ist das Eluat (lat. eluo, auswaschen, reinigen).
Nach dem Regenerieren ist ein Ionenaustauscher konfektioniert. Darunter versteht man allgemein, dass
ein Produkt für seine spezifische Nutzung bereit ist.
Das Ionenaustauscherharz füllt man in die Säule, die Lösung für die Austauschvorgänge dagegen gibt man auf
die Säule.
Weitere Texte zum Thema „Ionenaustauscher“