
Die Austauscher-Kapazität
Experimente:
Versuch: Kapazitätsbestimmung von Kationenaustauschern
Versuch: Kapazitätsbestimmung von Anionenaustauschern
Ein Ionenaustauscher kann nur eine bestimmte Anzahl an Ionen austauschen. Letztere ist wiederum
abhängig von der Anzahl der Ankergruppen. Ein Kationenaustauscher kann z. B. nur so viele einfach positiv
geladene Kationen aufnehmen, wie er Ankergruppen besitzt. Ein Maß hierfür ist
die Gewichts-Kapazität G. Sie ist definiert als die Anzahl der Ankergruppen
(in mmol), bezogen auf ein Gramm Ionenaustauscher:

Die Kapazität eines Ionenaustauschers kannst du sehr leicht durch eine Säure-Base-Titration der
Elektrolytlösung nach dem Austausch bestimmen (-> Versuch, ->
Versuch). Beachte dabei, dass der Kationenaustauscher zur experimentellen
Bestimmung der Kapazität vollständig mit H+-Ionen und der Anionenaustauscher vollständig mit
OH--Ionen beladen und neutral gewaschen sein müssen. Setzt
du den in dieser Form vorliegenden Austauschern nun Natriumchlorid im Überschuss zu, so werden
vom Kationenaustauscher H+-Ionen und vom Anionenaustauscher
OH--Ionen gegen Na+-Ionen bzw. Cl--Ionen ausgetauscht.
Man geht deshalb so vor, dass man eine bestimmte Menge an Ionenaustauscher mit überschüssiger Lauge (z. B.
100 ml einer 0,1 molaren Natronlauge) versetzt. Dann filtriert man ab und titriert das Filtrat mit Salzsäure zurück.
Die Anzahl der Ankergruppen des Ionenaustauschers ergibt sich dann aus der Differenz der
ursprünglichen Anzahl der OH--Ionen in 100 ml Natronlauge und der Anzahl der OH--Ionen
in 100 ml Natronlauge nach der Versuchsdurchführung. Die Erniedrigung der Hydroxid-Ionenkonzentration ist nämlich
auf die Protonenfreisetzung beim Kationenaustausch zurückzuführen.

Wenn du Gleichung 1 in Gleichung 2 einsetzt, kannst du darüber hinaus die Stoffmenge der Ankergruppen des Ionenaustauschers berechnen:
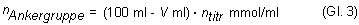
Weitere Texte zum Thema „Ionenaustauscher“