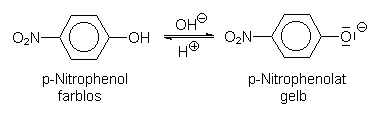
p-Nitrophenol-System
Indikatormoleküle genauer betrachtet
Säure/Base-Indikatoren sind schwache Säuren oder Basen, die Anionen bzw. Kationen bilden können. Diese Molekül-Ionen sind anders gefärbt als die ungeladenen Moleküle.
Die Farbwechsel beruhen auf Deprotonierung einer Farbsäure bzw. auf Protonierung einer Farbbase. Man spricht hier von einem farbvertiefenden Halochromie-Effekt. Grundlagen für diese Farbveränderungen sind durch Protonierung bewirkte Änderungen der elektronischen mesomeren Zustände im Molekül, die dadurch durch Strahlung höherer oder niedrigerer Energie anregbar gemacht werden. Die nicht absorbierte Strahlung wird abgegeben, was den Farbeindruck hervorruft.
Ein Beispiel für eine Indikatorsäure ist Para-Nitrophenol (pK-Wert 7,4). Es schlägt im neutralen Bereich von Farblos (sauer) nach Gelb (alkalisch) um. Dabei wird reversibel ein Proton aus dem Molekül abgegeben, wobei sich ein Phenolat-Anion bildet.
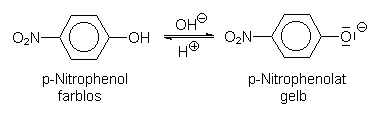
p-Nitrophenol-System
Das undissoziierte Molekül wird nur durch UV-Strahlung angeregt, absorbiert also kein sichtbares Licht und ist deswegen farblos. Das negativ geladene Molekül-Anion hat eine über das ganze Molekül verteilte Überschussladung, wodurch es bereits durch Strahlung mit niedrigerer Energie angeregt werden kann. Damit verschiebt sich die Absorption in den sichtbaren Spektralbereich. Es wird Blau absorbiert; die resultierende Farbe ist die Komplementärfarbe Gelb.
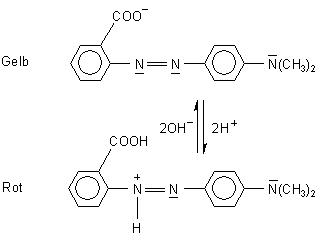
Ein Beispiel für eine Indikatorbase ist Methylrot (Umschlagsbereich pH 4,2 - 6,3). Dieser Azofarbstoff schlägt von Rot (sauer) nach Gelb (neutral bis alkalisch) um. Farbgebende Gruppe ist allein die Azogruppe. Die Carboxyl-Gruppe dient nur zur Erhöhung der Wasserlöslichkeit und ist selbst nicht an der Farbgebung beteiligt. Eine Protonierung findet unter diesen Bedingungen auch kaum am Dimethyl-Stickstoff wegen dessen geringer Basizität statt. Beide Gruppen sollten deswegen bei der folgenden Diskussion nicht weiter beachtet werden.
Methylrot-System
Durch reversible Protonierung entsteht im Sauren ein positiv geladenes Molekül-Kation, das durch energieärmere Strahlung anregbarer ist als die ursprüngliche Azoverbindung. Das Kation absorbiert Blaugrün, die Lösung zeigt also eine rote Färbung. Das ungeladene Molekül absorbiert kürzerwellig, nämlich Blau; damit zeigt die Lösung eine gelbe Farbe.
Weitere Texte zum Thema „Indikatoren“