 |
 |
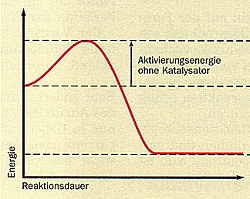
| Reaktionsdiagramme von Reaktionen
ohne und mit Katalysator
(Quelle: Cornelsen) |
Wie ein Katalysator wirkt
Eine einfache Einführung
Wasserstoff und Sauerstoff kann man vermischt aufbewahren, ohne dass diese miteinander reagieren. Denn für eine spontane Reaktion ist die Aktivierungsenergie zu hoch. Diese bringt man normalerweise auf, indem man das Gemisch mit einem Brenner entzündet.
Hält man jedoch fein verteiltes Platin in den Wasserstoffstrom, so gelingt die
Entzündung auch hiermit: Wenn der Wasserstoff an der Keramikperle vorbeiströmt,
beginnt sie nach einigen Sekunden zu glühen. Wird sie dann so bewegt, dass Luft
hinzutreten kann, entzündet sich das Gas mit einem leisen Knall. Das Gas brennt mit
ruhiger Flamme weiter; die Perle hat sich offensichtlich nicht verändert. Das fein
verteilte Platin in der Perle hat bewirkt, dass eine Knallgasreaktion abläuft, ohne dass
ein Zündfunke vorhanden ist.
Das Platin wirkt so, dass es die Aktivierungsenergie herabsetzt. Das Knallgasgemisch
reagiert deshalb schon bei niedrigen Temperaturen miteinander. Die freiwerdende
Reaktionsenergie bringt die Perle zum Glühen und entzündet dann das Gasgemisch.
Nun ist eine Zufuhr von Aktivierungsenergie nicht mehr notwendig, die Reaktion
aktiviert sich ständig selbst.
Das Platin wird bei der Reaktion nicht verbraucht, obwohl es an der Reaktion direkt
beteiligt ist.
Stoffe, die Reaktionen auslösen oder beeinflussen, ohne selbst verbraucht zu werden,
heißen Katalysatoren (griech. katalyein; auslösen). Deshalb kann man die Perlen
immer wieder verwenden.
Eine andere Katalysereaktion ist z. B. das Anzünden von Zucker. Dies gelingt nur in Gegenwart von Holzasche, von deren Bestandteilen besonders das Kaliumoxid als Katalysator wirkt. Auch die Zersetzung von Wasserstoffperoxid kann katalysiert werden.
Voraussetzung für eine Katalysereaktion ist zunächst, dass die Reaktion überhaupt möglich sein muss. Die Herabsetzung der Aktivierungsenergie kann man sehr schön in einem so genannten Reaktionsdiagramm (Bild 2) zeigen. Hier wird die Energieänderung im Verlaufe einer chemischen Reaktion deutlich. Man erkennt, dass man ausgehend von den Edukten zunächst den Betrag der Aktivierungsenergie zuführen muss, um die Edukte in einen Zustand zu überführen, aus dem heraus sie reagieren können. Dann bilden sich die Produkte, deren Energieinhalt um den Betrag der Reaktionsenergie niedriger ist. Die Aktivierungsenergie wird dabei wieder frei.
 |
 |
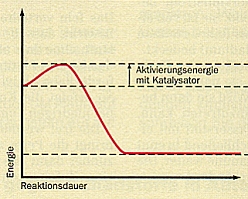
| Reaktionsdiagramme von Reaktionen
ohne und mit Katalysator
(Quelle: Cornelsen) |
Setzt man einen Katalysator ein, so bildet dieser mit Edukten Zwischenprodukte,
deren Bildung und Zerfall eine niedrigere Aktivierungsenergie erfordern als die
Reaktion ohne Katalysator.
Manchmal kann man das Auftreten der Zwischenprodukte direkt sehen. Dies ist der Fall bei der durch Cobaltchlorid katalysierten Oxidation von Seignettesalz mit Wasserstoffperoxid. Der Katalysator färbt die Lösung rot, die Katalysator-Edukt-Zwischenverbindung dagegen ist grün gefärbt.
Man kann also einen Katalysator als einen Stoff beschreiben, der an einem Reaktionskreisprozess teilnimmt, nach dessen Durchlaufen er wieder unverändert und zu neuer Reaktion bereit vorliegt. Dies hat man anhand des Braunsteins sehr gut zeigen können.
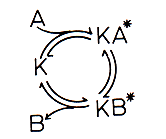
Katalyse-Kreisprozess
Je nach Aggregatzuständen der beteiligten Stoffe unterscheidet man homogene und
heterogene Katalysen. Liegen Edukte und Katalysator gelöst oder gasförmig vor, so
handelt es sich um homogene Katalysereaktionen. Beispiele sind Säurenkatalysen bei
der Estersynthese. Stickoxide wirken als Katalysatoren bei der bodennahen
Ozonbildung mit und sind deshalb in geringen Konzentrationen äußerst wirksam.
Cloratome sind Katalysatoren bei der Ozonzerstörung in der Stratosphäre.
Einige heterogene Katalysen haben wir bei der Zersetzung von Wasserstoffperoxid oder bei der Entzündung von Wasserstoff kennengelernt. Feste Katalysatoren nennt man auch "Kontakte".
Die Absenkung der Aktivierungsenergie hat einen rascheren Stoffumsatz zur Folge, bewirkt also eine Erhöhung der Reaktionsgeschwindigkeit.
Am Beispiel des Zerfalls von Wasserstoffperoxid in Wasser und Sauerstoff kann man weitere wichtige Aspekte der Katalysereaktionen kennenlernen.
2 H2O2 ———> 2 H2O + O2 /exotherm
So können bei ein und derselben Reaktion verschiedene Katalysatoren unterschiedlich wirken. So steigt die Reaktionsgeschwindigkeit bei Zugabe von Iod nur wenig, bei Kaliumchromat und besonders Braunstein stärker an. Besonders rasch wirkt Blut. In diesem ist ein Biokatalysator enthalten, die Katalase. Ein Katalase-Molekül zerlegt in einer Sekunde 3·1011 Wasserstoffperoxid-Moleküle, Iod dagegen nur 800. Biokatalysatoren sind also besonders wirksam, da sie die Aktivierungsenergie am stärksten herabsetzen.
Es ist aber auch möglich, durch Wahl eines Katalysators für ein gegebenes Eduktgemisch die Reaktionsrichtung zu bestimmen. Diese Reaktionslenkung ist von größter Wichtigkeit für die chemische Industrie. Man spricht von selektiver Katalyse.
Die Biokatalysatoren nennt man Enzyme (griech. en zyme, in der Hefe, im Sauerteig enthalten). Man hat sie früher vor allem bei der Herstellung von Alkohol (-> Versuch) benutzt. Sie sind bezüglich der Edukte ("Substrate") und ihrer Reaktionen sehr spezifisch. Ein Beispiel ist die Urease, ein Enzym, das Harnstoff (lat. urea) zersetzt.
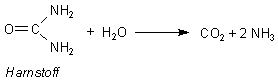
Die Urease kann bei der Reaktion zwischen Harnstoff und Thioharnstoff unterscheiden. Während sie den ersteren abbaut, bleibt der Thioharnstoff unangetastet.
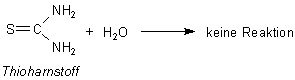
Man vergleicht hier treffend das Edukt als Schlüssel, das Enzym als Schloss, die zueinander passen müssen.
An den Enzymen kann man auch gut zeigen, dass Katalysatoren vergiftbar sind. Hier wirken vor allem Schwermetall-Ionen wie die vom Kupfer. Das gilt nicht nur für Enzyme, sondern besonders auch für Kontaktkatalysatoren in der Technik. So wird der Auto-Kat durch Blei, das aus verbleitem Benzin stammt, inaktiviert.
Die Verwendung von Katalysatoren ist für die Umwelt von großer Bedeutung. Das betrifft nicht nur die Abgasreinigung bei den Kraftfahrzeugen oder bei den Kraftwerken. Es gibt mittlerweile kaum noch ein Industrieverfahren ohne Beteiligung von Katalysatoren. Dadurch kann man Synthesen gezielt steuern und damit die Menge an Abfällen reduzieren. Die Nebenprodukte sind heute oftmals nicht mehr Abfälle, sondern "Koppelprodukte", die ebenfalls vermarktet werden können. Da die Aktivierungsenergie gesenkt wird, wird Energie eingespart und der Energieausstoß in die Umwelt geringer.
Nun können wir mit dem Chemiker A. Mittasch definieren, was ein Katalysator ist:
Ein Katalysator ist ein Stoff, der eine mögliche Reaktion hervorruft, ihre Geschwindigkeit verändert oder sie in eine bestimmte Richtung lenken kann, der jedoch in der Gleichung des resultierenden Umsatzes nicht auftritt.
Weitere Texte zum Thema „Katalyse“