Lokalelemente beruhen auf Katalysereaktionen
Experimente:
Modellversuche zur katalysierten Säurekorrosion
Versuch: Vom Lokalelement zum Voltaelement
Versuch: Opferanode
Korrosion ist Zersetzung von Metallen in Gegenwart von Wasser, Säuren, Salzen
und ggf. auch Sauerstoff.
Gefördert wird die Korrosion durch Lokalelemente. Diese bilden sich bei Berührung
von Metallen unterschiedlicher Elektronegativität. Solche Metallpaare sind z. B.
Eisen und Kupfer sowie Zink und Kupfer (-> Versuch).
An den Berührungspunkten korrodiert der unedle Partner, also Eisen oder Zink, ganz besonders rasch. Das
kann man mit einem einfachen Versuch zeigen: Die Zersetzung von Zink ist in (nicht
zu konzentrierter) Schwefelsäure gehemmt. Mit Kupfer dagegen setzt die Korrosion
rasch ein. Das riecht förmlich nach Katalyse.
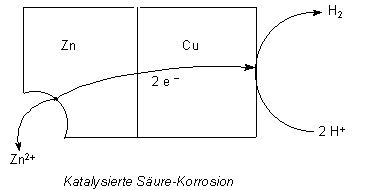
Das folgende Bild zeigt die Vorgänge.

Es handelt sich bei Korrosionsvorgängen um Redoxreaktionen. Die Reaktion ist in diesem speziellen Fall
Zn + 2 H+ ———> Zn2+ + H2
Zink überzieht sich rasch mit positiven Ionen und Wasserstoffbläschen, die den
Durchtritt von Protonen und deren Entladung unterbinden. Deshalb ist der Vorgang
gehemmt.
Geben wir ein edleres Metall wie Kupfer hinzu (das Kupfer bildet sich durch
Zementierung beim Zutropfen von Kupfersulfatlösung), so zieht dieses die
Elektronen an sich. Die Wasserstoff-Ionen werden an der Kupferoberfläche
entladen, die Zink-Ionen können das Metallgitter verlassen.
Das unedle Zink zersetzt sich, das edlere Kupfer bleibt erhalten. Deshalb darf man kein Zink- oder Eisendach mit Kupfernägeln befestigen. Das Dach würde bald wegfliegen, da sich um die Kupfernägel rasch Lochfraß entwickelt.
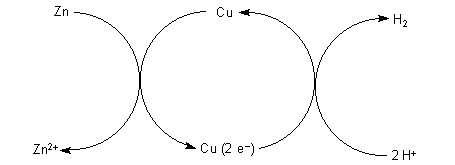
Da Redoxreaktionen bekanntlich Elektronen-Übertragungsreaktionen sind, können wir den Redoxprozess statt wie im Lokalelement unter Kurzschlussbedingungen auch in getrennten Räumen ablaufen lassen, die wir über einen äußeren Leiter elektrisch verbinden (-> Versuch). Dann können wir auch einen Verbraucher, z. B. einen Solarmotor damit betreiben. So wird die Reaktionsenergie nicht in Wärme, sondern in elektrische Energie umgewandelt. Das ist die Grundlage der galvanischen Elemente. Bei denen handelt es sich fast immer um Katalyseeffekte an Elektroden. Das Voltaelement gehört dazu. Diese Zusammenhänge erläutern wir exemplarisch auch an der Brennstoffzelle.
Interessant ist, dass sich auch die Korrosionsschutzmaßnahmen der Korrosion bedienen. Wenn man zum Beispiel Eisen gegen Zink oder Magnesium schaltet, so lösen sich die unedlen Metalle auf, Eisen bleibt, da es Elektronen zu sich zieht, von der Korrosion verschont (-> Versuch). Treffend spricht man hier von einer Opferanode.
Weitere Texte zum Thema „Katalyse“