Sodaherstellung nach dem Solvay-Verfahren
Sicherlich nicht nur aus Gründen des Umweltschutzes, sondern auch, weil sich das Leblancsche Verfahren als unwirtschaftlich erwiesen hatte, wurde 1860 von Solvay eine weniger umweltschädigende Variante zur Sodaherstellung entwickelt. Die Gesamtreaktion ist formal:
2 NaCl + CaCO3 ———> CaCl2 + Na2CO3
So einfach läuft die Synthese natürlich nicht ab. Ist das wieder eine der unmöglichen
Reaktionen? Denn Soda ist ein leichtlösliches Carbonat und kann aus dem
Reaktionsgemisch nicht abgetrennt werden. Zudem ist Calciumcarbonat
schwer löslich, die Konzentration von Carbonat-Ionen wäre deshalb viel zu gering.
Anders, nämlich umgekehrt, ist es mit der Löslichkeit der Hydrogencarbonate:
Calciumhydrogencarbonat ist leicht löslich, das von Natrium etwas weniger
leicht löslich. Deshalb muss man dafür sorgen, dass statt Carbonat-Ionen vorrangig
Hydrogencarbonat-Ionen gebildet werden. Das macht man mit einem Katalysator, der
hier einen ganz anderen Aspekt der Katalyse zeigt. Es geht hier um die
Aufrechterhaltung eines schwach alkalischen pH-Milieus.
Die Rolle eines entsprechenden Katalysators spielt beim Solvay-Verfahren die
Brönsted-Base Ammoniak. Es ist weniger basisch als das Carbonat-Ion und kann
deshalb Protonen an dieses Ion abgeben. Das kann man schon an den pKs-Werten
ablesen: Der von Ammoniak/Ammonium ist 9,25, der von Carbonat/Hydrogencarbonat
10,33. Andererseits kann Ammoniak aber auch Protonen von der Kohlensäure
abspalten und so die Löslichkeit von CO2 in Wasser erhöhen. Damit hat man eine
hohe Konzentration von Hydrogencarbonat mit geringen Carbonatanteilen vorgelegt.

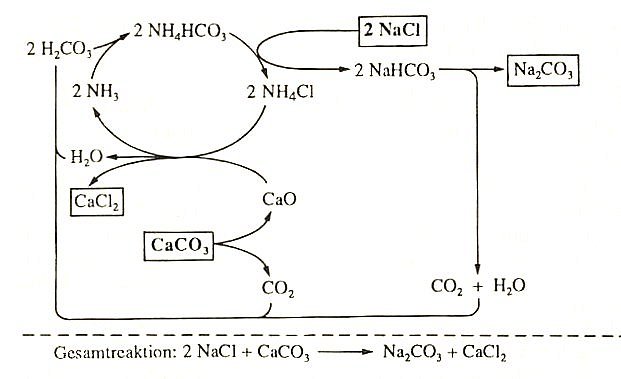
Reaktionsschema des Solvay-Verfahrens
Zum Mechanismus:
In Wasser wird unter Kühlung Ammoniak, dann unter Erwärmung CO2 eingeleitet. Es
bilden sich Ammonium- und Hydrogencarbonat-Ionen. Dazu gibt man
Natriumchloridlösung. Es fällt beim Abkühlen Natriumhydrogencarbonat aus. Das
trennt man ab, erwärmt es vorsichtig. Dabei wird CO2 und Wasser frei, Soda bildet
sich. Das CO2 führt man wieder in den Prozess zurück.
Zum Nachschub des verbrauchten CO2 brennt man Kalk. Den gebrannten Kalk CaO
gibt man als starke Alkalie in die verbliebene Lösung von Ammoniumchlorid; NH3 wird
freigesetzt. Dann trennt man CaCl2 ab. Die Lösung wird wieder mit NH3 gesättigt und
anschließend mit CO2. Die Lösung enthält nun NH4+- sowie
HCO3--Ionen. Man ist also wieder am Anfang des Katalysekreisprozesses angelangt.
Zu den genauen chemischen Abläufen lies unsere Soda-Webseite.
Weitere Texte zum Thema „Katalyse“