Versuch: Kupferchlorid katalysiert die Säure-Korrosion von Aluminium
Schülerversuch; 10 min.
Beim Experimentieren den Allgemeinen Warnhinweis unbedingt beachten.
Geräte
Thermometer.
Chemikalien
4 Teelichtbecher aus Aluminium, Lösungen (c = 0,1 mol/l) (Xn) von Kupfer(II)-sulfat
und Kupfer(II)-chlorid, Natriumchlorid.
Durchführung
Die Teelichtbecher müssen innen völlig fett- und wachsfrei sein. Dazu reinigt man sie
zuvor mit Benzin (F+).
In einen Teelichtbecher gibt man zunächst Leitungswasser. Er dient zum Vergleich.
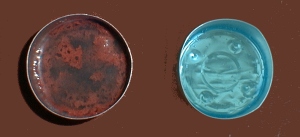
In den zweiten füllt man die Kupfer(II)-sulfatlösung. In den dritten gibt man die
Kupfer(II)-chloridlösung.
Während in den ersten beiden Gefäßen jegliche chemische Reaktion ausbleibt, setzt
sie im dritten augenblicklich ein. Dabei wird die Lösung heiß.

Teelichtbecher mit links: CuCl2 ; rechts: CuSO4
(Foto: Daggi)
Nach etwa einer Stunde beginnt auch im zweiten Gefäß die Abscheidung von etwas Kupfer und ein wenig Wasserstoff.
Für einen neuen Ansatz füllt man in einen Teelichtbecher Natriumchloridlösung (w = 10 %) und gibt dazu einige Tropfen Kupfer(II)-chlorid-Lösung. Nun ist zwar die Kupferabscheidung nicht so deutlich, dafür tritt aber die starke, katalysierte Wasserstoffentwicklung visuell in den Vordergrund. Nach kurzer Zeit läuft der Becher aufgrund der korrosiv gebildeten Löcher aus.