grün blau
Der Chelateffekt
Experimente:
Versuch: Erhöhte Komplexstabilität durch Chelatbildung
Eine wässrige Nickel(II)-Lösung lässt sich mit konzentrierter Ammoniaklösung in den blauen
Hexaamminnickel(II)-Komplex überführen. Durch Verdünnen mit Wasser kann das Gleichgewicht
dieser Reaktion aber relativ leicht wieder nach links verschoben werden (->
Versuch).
[Ni(H2O)6]2+ + 6 NH3
![]() [Ni(NH3)6]2+ + 6 H20
[Ni(NH3)6]2+ + 6 H20
grün
blau
Versetzt man eine blaue Hexaamminnickel(II)-Lösung mit Ethylendiamin, entsteht der violette Tris(ethylendiamin)nickel(II)-Komplex. Durch erneute Zugabe von konzentrierter Ammoniaklösung lässt sich dieses Gleichgewicht allerdings nicht mehr so einfach auf die andere Seite verschieben (-> Versuch).
[Ni(NH3)6]2+ + 3 en
![]() [Ni(en)3]2+ + 6 NH3
[Ni(en)3]2+ + 6 NH3
blau
violett
(Beim ersten Versuchsteil tritt durch das alkalische Milieu leider eine störende Hydroxidfällung auf.)
 |
| RG1: grüner Aquakomplex
RG2: blauer Amminkomplex RG3: Rückkehr zum Aquakomplex nach Wasserzugabe RG4: violetter Chelatkomplex RG5: Keine Rückkehr zum Amminkomplex nach Ammoniakzugabe |
| (Foto: Sandra) |
Obwohl beide Komplexe eine ähnliche Struktur besitzen, ist dieser en-Komplex
(KB = 1012 mol-3 · l3)
bedeutend stabiler als der Amminkomplex (KB =
109 mol-6 · l6).
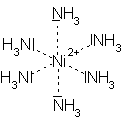 |
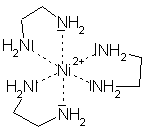 |
| Amminkomplex | en-Komplex |
Chelatkomplexe sind allgemein immer stabiler als vergleichbare Komplexe mit einzähnigen Liganden.
Man bezeichnet dieses Phänomen als Chelateffekt.
Wie ist dieser Effekt zu erklären?
Dafür gibt es zwei Gründe:
| 1. | Ist bei einer Komplexbildung das erste Atom eines Chelatliganden
schon bereits am Zentralteilchens gebunden, begünstigt das die Bindung von weiteren Bindungsstellen
dieses Liganden, da diese ja schon nah am Zentrum liegen.
Bei einer Ligandenaustauschreaktion müssen außerdem erst alle Bindungen des Chelatliganden gleichzeitig abgespalten werden, um ihn gegen einen anderen Liganden auszutauschen. Bei einzähnigen Liganden erfolgt dies schon bei der Spaltung einer Bindung. |
| 2. | Durch den Austausch von mehreren einzähnigen Liganden durch
einen Chelatliganden erhöht sich die Anzahl der freien Teilchen in der Lösung. Dadurch kommt
es zu einer Zunahme der Entropie. D. h. es herrscht ein Zustand von
größerer Unordnung, der spontan ablaufende Reaktionen begünstigt.
Das Gleichgewicht verschiebt sich somit auf die Seite der Chelatkomplexbildung. |
Weitere Texte zum Thema „Komplexverbindungen“