 |
| Blaues Kupfersulfat
(Foto: Sandra) |
Welche Farbe hat das Kupfer(II)-Ion?
Experimente:
Versuch: Reversible Dehydratisierung von Kupfersulfat-Pentahydrat
Schaut man sich Kupfersulfat an, so sieht man schöne blaue Kristalle.
Auf dem Flaschenetikett steht die Formel:
CuSO4 · 5 H20
Es ist also auch zu fünf molaren Teilen Wasser in diesem Salz enthalten. Solch eine Formel hat auch das allerdings farblose Glaubersalz, Na2SO4 · 10 H2O. Da sowohl Wassermoleküle als auch Sulfat-Ionen farblos sind, müsste dann nicht die blaue Farbe von den Kupfer-Ionen stammen?
 |
| Blaues Kupfersulfat
(Foto: Sandra) |
Wenn man nun aber die blauen Kristalle vorsichtig erhitzt, entweicht
Wasser und man erhält merkwürdigerweise ein weißes Salz. Andersherum
färbt sich dieses sofort wieder blau, sobald es wieder mit Wasser
in Berührung kommt (-> Versuch). (Diese Reaktion
nutzt man auch zum Nachweis von Wasser.)
Welche Farbe hat denn nun das Kupfer-Ion?
Um das zu klären, müssen wir uns den molekularen Aufbau des Kupfersulfats genauer ansehen.
Die Wassermoleküle bilden eine quadratisch-planare Struktur um das Kupfer-Ion herum.
Dadurch verändert das Metall-Ion seine Farbe zu Blau. Durch das
Erhitzen wird diese Struktur zerstört, und das Kupfersulfat liegt
wieder in seiner reinen, farblosen Form vor.
Diese Art von Verbindung eines Metall-Ions mit Wassermolekülen
nennt man allgemein eine Komplexverbindung
(complexus (lat.) = verbunden). In diesem speziellen Fall
handelt es sich um einen Wasser-
oder (lateinisch) Aquakomplex.
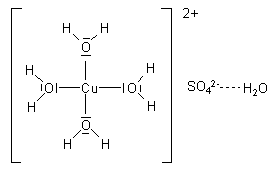 |
Es ordnen sich hier vier der fünf Wassermoleküle in kovalenter Bindung um das Kupfer-Ion, während das fünfte über Wasserstoffbrücken an das Sulfat-Ion gebunden ist. Aus diesen Komplex-Ionen wird auch das Kristallgitter aufgebaut. Um das zu berücksichtigen, schreibt man die Formel von wasserhaltigem Kupfersulfat so:
[Cu(H2O)4]SO4 · H2O
Das blanke Kupfer(II)-Ion ist also farblos!
Und was das Glaubersalz angeht: Hierbei handelt es sich nicht um einen Komplex, sondern um ein Salzhydrat. Das heißt Natriumsulfat-Dekahydrat. Auch im Kristall vom Glaubersalz liegen die Wassermoleküle nicht gebunden vor, sondern sind nur locker fixiert. Die Bindungen zwischen Wassermolekülen und Ionen sind vergleichbar mit denen in einer Salzlösung. Allerdings sind die Wassermoleküle im Kristallgitter streng ausgerichtet und hochgeordnet fixiert - aber eben nicht komplex an das Na-Ion gebunden. Das ist der Unterschied zu dem Kupfersulfat-Pentahydrat-Kristall.
Weitere Texte zum Thema „Komplexverbindungen“