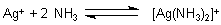
Für Experten: Praktische Bestimmung der Stabilitätskonstante
Experimente:
Versuch: Elektrochemische Bestimmung der Stabilitätskonstante
von Diamminsilber(I)
Stabilitätskonstanten lassen sich auf elektrochemischem Weg über eine Konzentrationszelle
bestimmen. Schauen wir uns das am Beispiel des Diamminsilber(I)-Komplexes an (->
Versuch). Dazu baut man eine Apparatur mit zwei Halbzellen auf.
Die Halbzellen sind durch ein Diaphragma getrennt. In beide füllt man gleichkonzentrierte
Silbernitratlösung. In eine Zelle gibt man dazu noch etwas Ammoniaklösung.
Es liegen nun zwei Halbzellen vor, deren Redoxpotential von der Konzentration an Silber-Ionen bestimmt wird. Wichtig: Bei dieser Messung werden nicht die im Komplex gebundenen Silber-Ionen erfasst, sondern nur die freien Silber-Ionen, die sich aufgrund der Komplexdissoziation in Lösung befinden.
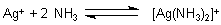
Deshalb hat die Halbzelle mit Silbernitrat ein höheres Potential, die andere mit Ammoniakzusatz
ein niedrigeres.
Folglich misst man eine Spannungsdifferenz DU. Sie beträgt bei unserer
Messung 0,413 Volt.
Die gesuchte Stabilitätskonstante ist:
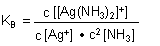
Um nun ihren Wert zu bestimmen, benötigt man ein paar Rechenschritte.
DU = 0,059 V · lg {ca(Ag+) / c(Ag+)}
Dabei ist ca(Ag+) die Gesamtkonzentration der Silber-Ionen, also auch der im
Komplex gebundenen.
Daraus ergibt sich durch Umstellen der Gleichung:
c(Ag+) = 10 -DU / 0,059 V · ca(Ag+)
c(NH3) = ca(NH3) - 2 ca(Ag+)
Dabei ist ca(NH3) die Gesamtkonzentration des Ammoniaks. Der Faktor 2 kommt daher, dass ein im Komplex-Ion enthaltenes Silber-Ion zwei Ammoniakmoleküle bindet.
c([Ag(NH3)2]+) = ca(Ag+)
KB = 10DU / 0,059 V / (ca(NH3) - 2 ca(Ag+))2
Setzt man in diese Gleichung die Werte aus dem Versuch ein, erhält man:
KB = 10 0,413 V / 0,059 V / (2,4 mol/l - 0,2 mol/l)2
KB = 2,1 · 106 l/mol
Der Literaturwert ist etwas höher (1,2 · 107). Die geringe Abweichung erklärt sich unter anderem aus den Vereinfachungen, die wir bei der Herleitung der Gleichungen gemacht haben.
Weitere Texte zum Thema „Komplexverbindungen“