Die Struktur von Komplexen
Die Liganden ordnen sich nicht zufällig, sondern in der Form eines symmetrischen Körpers um das Zentralteilchen. Und zwar so, dass die geringste Abstoßung der Liganden untereinander und die größtmögliche Anziehung durch das Zentralteilchen gewährleistet werden. Dadurch entsteht ein starkes elektrostatisches Feld. Man nennt dieses Feld auch Kristallfeld oder Ligandenfeld.
Bei der Anordnung der Liganden existieren zahlreiche geometrische Figuren. Die am häufigsten auftretenden Strukturen sind die tetraedrischen, quadratisch-planaren und oktaedrischen. Während die beiden erst genannten Formen eine Koordinationszahl 4 voraussetzen, handelt es sich bei oktaedrischen Komplexen um Verbindungen mit der Koordinationszahl 6.
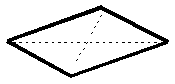
| KZ 4: |  |
quadratisch-planare Struktur |
Beispiele sind das Tetraamminkupfer(II) [Cu(NH3)4]2+, Tetraaquakupfer(II) [Cu(H2O)4]2+ oder das Tetrachlorocuprat(II) [CuCl4]2-.
| KZ 4: | 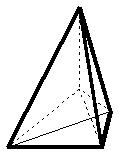 |
tetraedrische Struktur |
Diese Strukturform findet man beim Tetracyanocuprat(II) [Cu(CN)4]2-, Tetrachloronickelat(II) [NiCl4]2- oder dem Tetrahydroxoaluminat [Al(OH)4]-.
| KZ 6: | 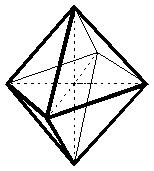 |
oktaedrische Struktur |
Diese Komplexe sind sehr häufig. Viele Hexaaquakomplexe liegen in wässriger Lösung in oktaedrischer Form vor. Andere Beispiele sind das Hexaamminnickel(II) [Ni(NH3)6]2+ oder das Hexacyanoferrat(II) [Fe(CN)6]4-.
Besonders wichtig sind die Komplexe mit mehrzähnigen, meist organisch-chemischen Liganden, die Chelate.
Weitere Texte zum Thema „Komplexverbindungen“