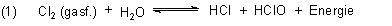
Das so genannte Domestos-Problem
Obwohl es mit dem heutigen Produkt gleichen Namens nichts mehr zu tun hat: Der Name Domestos steht in der Chemiegeschichte für einige spektakuläre Haushaltsunfälle. Manche Hausfrauen und -männer konnten es nicht sauber genug haben: Sie kippten erst das desodorierende Domestos ins Klo und dann den stark sauren WC-Reiniger darauf. Die Folge waren starke Chlorausgasungen, die manche Hausfrauen und Hausmänner erst ziemlich atemlos machten und dann irreversibel flachlegten.
Wenn man weiß, dass Chlor zu den Panikgasen gehört, dann kann man sich gut vorstellen, was sich da an deutschen WCs abgespielt haben muss... (Zur Wirkung von Chlor auf den Menschen sei auch daran erinnert, dass das im ersten Weltkrieg zuerst eingesetzte Giftgas schlichtes Chlor war - pikanterweise auf Anraten vom famosen Chemiker Fritz Haber.)
Hinter diesen Unglücken steckt ein chemisches Gleichgewicht, das exemplarisch für das 1884 formulierte Prinzip von Le Chatelier steht. Es handelt sich um das Gleichgewichtssystem Chlor/Wasser.
Leitet man Chlorgas in Wasser ein, so bildet sich eine saure Lösung einer Mischung von Salzsäure HCl und unterchloriger Säure HClO.
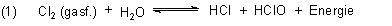
Man spricht von einer Disproportionierungsreaktion. Hier wechselt ein Element aus einer mittleren Redoxlage (Oxidationszahl 0) in eine niedrigere (-I) und eine höhere (+I).
Dieses Gleichgewicht kann man (entsprechend dem Prinzip von Le Chatelier) nach rechts, also in Richtung auf die für die Herstellung der Bleichlauge oder des Reinigers gewünschte Produktbildung verschieben. Entsprechende Parameter sind
Gerade letzteres nutzt man zur Herstellung von Bleichlaugen, aber auch von Haushaltsreinigern wie dem genannten Domestos. Man leitet Chlor in Natronlauge ein. Dabei werden die Protonen aus dem Gleichgewicht (1) abgefangen. Es bildet sich eine relativ stabile Mischung von gelöstem Natriumchlorid und Natriumhypochlorit, die allerdings stark alkalisch ist.
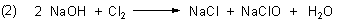
Bei dieser Chlorlösung liegt das Gleichgewicht völlig auf der rechten Seite.
Gibt man jedoch stark saure WC-Reiniger hinzu, so wird das Gleichgewicht (1) bzw.
seine Extremlage (2) durch die Protonenzufuhr umgekehrt, d. h. es wird in Richtung auf
Chlorfreisetzung verschoben. Hinzu kommt die starke Erwärmung durch die Neutralisationsenergie.
Somit wird insgesamt eine große Menge an Chlorgas frei.
Bei diesen Unglücken wird schlicht das Redoxsystem der obigen Gleichungen (1) und (2)
umgekehrt. Man spricht von einer Symproportionierungsreaktion. Hier wechselt ein Element
aus einer niedrigeren (-I) sowie einer höheren (+I) Redoxlage in eine mittlere (Oxidationszahl 0).
Wie wirkt übrigens diese Bleichlösung auf Chlorbasis? Chlor ist ein starkes Oxidationsmittel, das zum Beispiel Farbstoffe ausbleicht und Bakterien niedermacht. Genau genommen ist es aber nicht das Chlor selbst, sondern das sich aus dem Hypochlorit mit Wasser bildende Sauerstoffatom, das bleichaktiv ist. Man nennt die Bleichlauge übrigens auch Eau de Javelle.
Wie gesagt - das neue Domestos ist ein entschärftes Produkt. Aber auch hier gilt der aufgedruckte Warnhinweis: Nicht mit anderen Reinigungsmitteln zusammen verwenden!
Also: Bitte bei einer Marke bleiben und nicht panschen!
Weitere Texte zum Thema „Chemisches Gleichgewicht und Massenwirkungsgesetz“