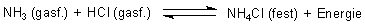
Die Gleichgewichte des Ammoniumchlorids
Experimente:
Versuche zu den Gleichgewichten des Ammoniumchlorids
Ammoniumchlorid NH4Cl ist ein Salz, das sich bildet, ohne dass daran Wasser beteiligt ist. Es ist ein Beispiel für eine klassische Brönsted-Säure/Base-Reaktion. Andererseits zersetzt sich Ammoniumchlorid beim Erhitzen. Wir haben es hier also mit einer Gleichgewichtsreaktion zu tun.
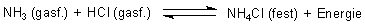
Löst man Ammoniumchlorid in Wasser, so beobachtet man eine saure Reaktion. Dahinter steckt das Protolysegleichgewicht des Ammonium-Ions.
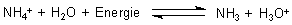
Ammoniak lässt sich aus Ammoniumchlorid mit einer starken Base wie Natriumhydroxid oder Calciumoxid austreiben.
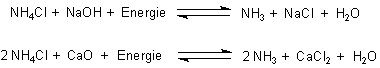
Auch dies sind chemische Gleichgewichte.
Ammoniumchlorid ist in Lakritzprodukten als Säuerungsmittel enthalten. Dazu haben wir eine Webseite gemacht, in der auch die Experimente zum Kennenlernen der eben angesprochenen Gleichgewichte beschrieben sind.
Weitere Texte zum Thema „Chemisches Gleichgewicht und Massenwirkungsgesetz“